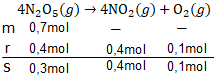Iklan
Pertanyaan
Sebanyak 0,7 mol dinitrogen pentaoksida ( N 2 O 5 ) dipanaskan dalam ruangan 5liter sehingga terurai membentuk NO 2 dan O 2 menurut reaksi berikut: 2 N 2 O 5 ( g ) → 4 NO 2 ( g ) + O 2 ( g ) Dalam 10 detik pertama terbentuk 0,1 mol oksigen. Laju peruraian N 2 O 5 adalah ....
Sebanyak 0,7 mol dinitrogen pentaoksida dipanaskan dalam ruangan 5 liter sehingga terurai membentuk dan menurut reaksi berikut:
Dalam 10 detik pertama terbentuk 0,1 mol oksigen. Laju peruraian adalah ....
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
10
4.7 (15 rating)
AP
Auliya Paramitaa
Jawaban tidak sesuai Pembahasan tidak lengkap
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia