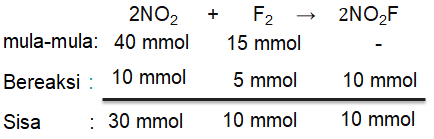Iklan
Pertanyaan
Reaksi pembentukan gas NO 2 F dari gas NO 2 dan F 2 mengikuti reaksi berorde 1 setiap reaktan dengan nilai tetapan laju reaksi sebesar 0,75 M − 1 s − 1 .Jika ke dalam 250 mL labu dimasukkan 40 mmol dan 15 mmol . Laju reaksi setelah 25% bereaksi adalah ...
Reaksi pembentukan gas dari gas dan mengikuti reaksi berorde 1 setiap reaktan dengan nilai tetapan laju reaksi sebesar 0,75 . Jika ke dalam 250 mL labu dimasukkan 40 mmol dan 15 mmol
. Laju reaksi setelah 25%
bereaksi adalah ...
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
3
4.8 (8 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia