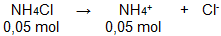Iklan
Pertanyaan
Sebanyak 0,1 mol NH 4 OH ( K b = 1 0 − 5 ) dicampurkan dengan 0,05 mol NH 4 CI hinggavolume 1liter. pH larutan yang dihasilkanadalah ....
Sebanyak 0,1 mol dicampurkan dengan 0,05 mol hingga volume 1 liter. pH larutan yang dihasilkan adalah ....
5
5 + log 2
5 - log 2
9 + log 2
9 - log 2
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
7
4.7 (20 rating)
Zh
Zahra haniyah firdaus
Makasih ❤️
KM
Kanaya Melodia Banatri
Pembahasan lengkap banget Mudah dimengerti Makasih ❤️
AZ
Azizah Zaskia
Pembahasan lengkap banget
zk
zulfa kumalasari
Pembahasan tidak menjawab soal Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia