Iklan
Iklan
Pertanyaan
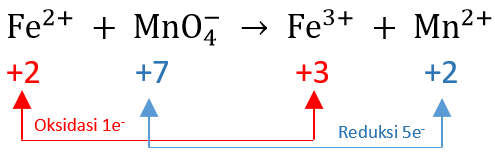
Sampel bijih besi yang massanya 0,28 gram dilarutkan dalam asam berlebih. Semua besi mula-mula dirubah menjadi Fe(II). Larutan ini kemudian memerlukan 20 mL KMnO 4 0,02 M untuk mengoksidasinya menjadi ion Fe(III) dengan hasil samping ion Mn 2 + . Berapa kadar Fe dalam bijih tersebut?
Sampel bijih besi yang massanya 0,28 gram dilarutkan dalam asam berlebih. Semua besi mula-mula dirubah menjadi Fe(II). Larutan ini kemudian memerlukan 20 mL 0,02 M untuk mengoksidasinya menjadi ion Fe(III) dengan hasil samping ion . Berapa kadar Fe dalam bijih tersebut?
10%
20%
30%
40%
50%
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
23
5.0 (1 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia