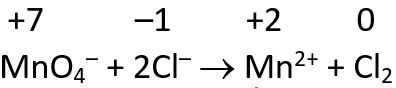a. Persamaan reaksi redoks yang setara:
 bereaksi dengan
bereaksi dengan  menghasilkan
menghasilkan  dan
dan  sehingga dapat dituliskan:
sehingga dapat dituliskan:

Langkah penyetaraan reaksi redoks pada keadaan asam dengan metode biloks:
Tentukan unsur yang mengalami perubahan bilangan oksidasi. Unsur Mn mengalami reduksi dari +7 menjadi +2, sedangkan unsur Cl mengalami oksidasi dari -1 menjadi 0. Kemudian, setarakan unsur yang mengalami perubahan bilangan oksidasi.
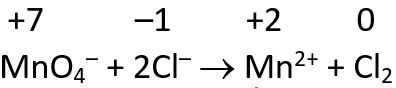
Kalikan bilangan oksidasi dengan subskrip dan koefisien.
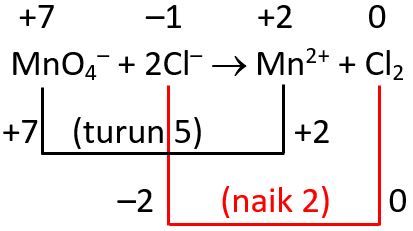
Setarakan perubahan bilangan oksidasi dengan mengalikan 2 pada Mn dan mengalikan 5 pada Cl sehingga reaksinya menjadi:

Setarakan jumlah atom O dengan menambahkan  pada ruas yang kekurangan atom O, yaitu ruas kanan membutuhkan 8
pada ruas yang kekurangan atom O, yaitu ruas kanan membutuhkan 8  . Reaksinya menjadi:
. Reaksinya menjadi:

Setarakan jumlah atom H dengan menambahkan ion  pada ruas yang kekurangan atom H, yaitu ruas kiri membutuhkan 16 ion
pada ruas yang kekurangan atom H, yaitu ruas kiri membutuhkan 16 ion  .
.

atau 
Reaksi tersebut sudah tersebut sudah setara karena jumlah atom dan muatan sudah sama.
b. Normalitas 
Dari persamaan reaksi diketahui bahwa 2  ekuivalen dengan 10
ekuivalen dengan 10  , maka normalitas
, maka normalitas  :
:

c. Molaritas 
Molaritas dapat ditentukan dari nilai normalitasnya. Normalitas adalah banyaknya mol ekuivalen zat terlarut dalam 1 liter larutan, sedangkan molaritas menyatakan banyaknya mol zat terlarut dalam 1 liter larutan. Untuk  , nilai ekuivalennya (n) sebesar 5 (melepas 5 elektron untuk membentuk
, nilai ekuivalennya (n) sebesar 5 (melepas 5 elektron untuk membentuk  ). Maka:
). Maka:

Jadi, persamaan reaksi setaranya adalah  ; normalitas
; normalitas  sebesar 0,04 N; dan molaritas
sebesar 0,04 N; dan molaritas  sebesar 0,008 M.
sebesar 0,008 M.
tetap dititrasi dengan
0,1 N sebanyak 20 mL. Tentukan: