Iklan
Pertanyaan
Reaksi fasa gas: 2 NO ( g ) + Br 2 ( g ) → 2 NOBr ( g ) dilakukan dalam wadah tertutup dengan konsentrasi awal reaktan yang berbeda-beda. Pada tabel di bawah ini, yang dimaksud dengan waktu reaksi ( t ) adalah waktu dari awal reaksi sampang hilangnya warna Br 2 . Berdasarkan data ini, persamaan laju reaksi tersebut adalah ...
Reaksi fasa gas:
dilakukan dalam wadah tertutup dengan konsentrasi awal reaktan yang berbeda-beda. Pada tabel di bawah ini, yang dimaksud dengan waktu reaksi (t) adalah waktu dari awal reaksi sampang hilangnya warna .
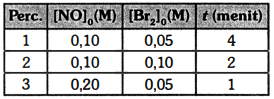
Berdasarkan data ini, persamaan laju reaksi tersebut adalah ...
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
4
5.0 (5 rating)
nn
nasywa nafiah
Pembahasan lengkap banget Ini yang aku cari! Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















