Iklan
Pertanyaan
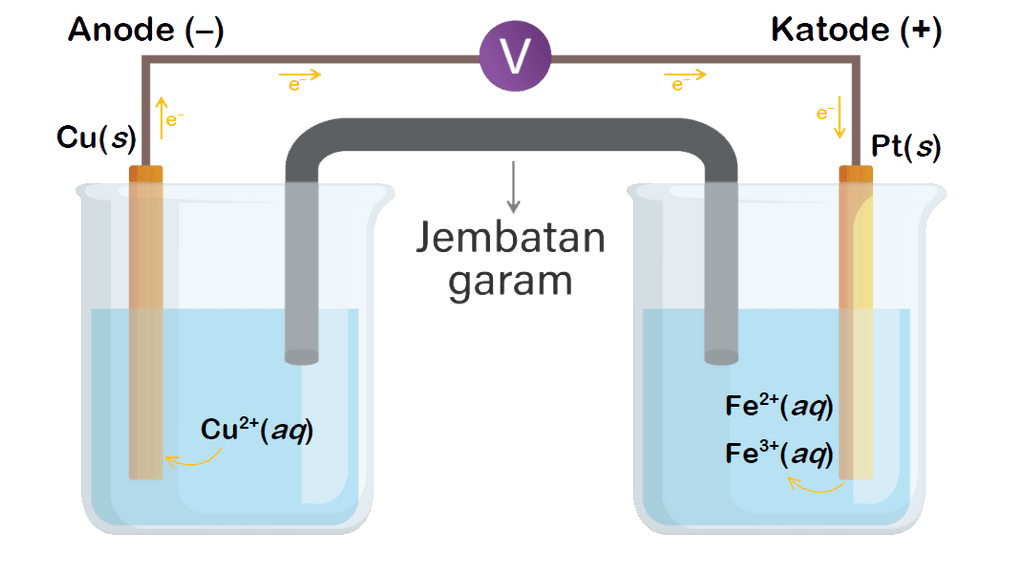
Pertimbangkan sel galvani berikut: Cu ( s ) ∣ Cu 2 + ( 1 M ) ∣∣ Fe 3 + ( 1 M ) , Fe 2 + ( 1 M ) ∣ Pt ( s ) Cu ( s ) ∣ Cu 2 + ( 1 M ) ∣∣ Fe 3 + ( 1 M ) , Fe 2 + ( 5 M ) ∣ Pt ( s ) Cu ( s ) ∣ Cu 2 + ( 0 , 1 M ) ∣∣ Fe 3 + ( 0 , 1 M ) , Fe 2 + ( 0 , 1 M ) ∣ Pt ( s ) Buatlah rangkaian sel volta, kemudian beri label bagian anoda dan katoda, tentukan arah aliran elektron dan ion.
Pertimbangkan sel galvani berikut:
Buatlah rangkaian sel volta, kemudian beri label bagian anoda dan katoda, tentukan arah aliran elektron dan ion.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
2
4.5 (2 rating)
ij
irene julia letuna
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia