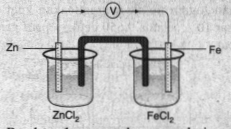
Sel volta atau sel galvani adalah salah satu macam dari sel elektrokimia. Sel volta mengubah energi kimia dari reaksi redoks menghasilkan arus listrik. Adapun elektroda pada sel volta adalah:
Katoda:
Merupakan kutub positif atau elektroda positif
Tempat terjadi reaksi reduksi
Anoda:
Merupakan kutub negatif atau elektroda negatif
Tempat terjadi reaksi oksidasi
Untuk dapat menetukan zat mana yang mengalami reduksi dan mana yang mengalami oksidasi maka kita harus melihat dari urutan deret volta sebagai berikut:
Li-K-Ba-Ca-Na-Mg-Al-Mn-Zn-Cr-Fe-Cd-Ni-Co-Sn-Pb-H-Cu-Hg-Ag-Pt-Au
Semakin ke kanan semakin besar nilai potensial reduksinya, maka unsur yang lebih kanan akan mengalami reduksi dan yang lebih kiri akan mengalami oksidasi.
Antara Zn dan Fe yang lebih kanan adalah Fe, maka:
Mengalami reaksi reduksi: ion Fe
Ion  dari larutan
dari larutan  akan mengalami reduksi
akan mengalami reduksi

Logam Fe (besi) hasil reaksi reduksi akan menempel pada elektroda sehingga elektroda Fe semakin tebal.
Mengalami reaksi oksidasi: logam Zn
Logam Zn dari elektroda akan mengalami oksidasi

Logam Zn akan teroksidasi menjadi ion  sehingga elektroda Zn akan menipis
sehingga elektroda Zn akan menipis
Jadi bisa kita tuliskan
Reaksi reduksi : 
Reaksi oksidasi : 
Untuk penulisan notasi sel :

Maka:

Jadi, jawaban yang benar adalah D