Iklan
Pertanyaan
Perhatikan proses elektrolisis logam tembaga menggunakan elektroda Fe berikut ini! Proses elektrolisis ini berlangsung selama 965 detik dengan menggunakan arus 2 A. Tentukan reaksi yang terjadi di katoda dan anoda serta hitunglah massa logam yang digunakan untuk menyepuh tersebut! ( A r Cu = 63 , 5 )
Perhatikan proses elektrolisis logam tembaga menggunakan elektroda Fe berikut ini!
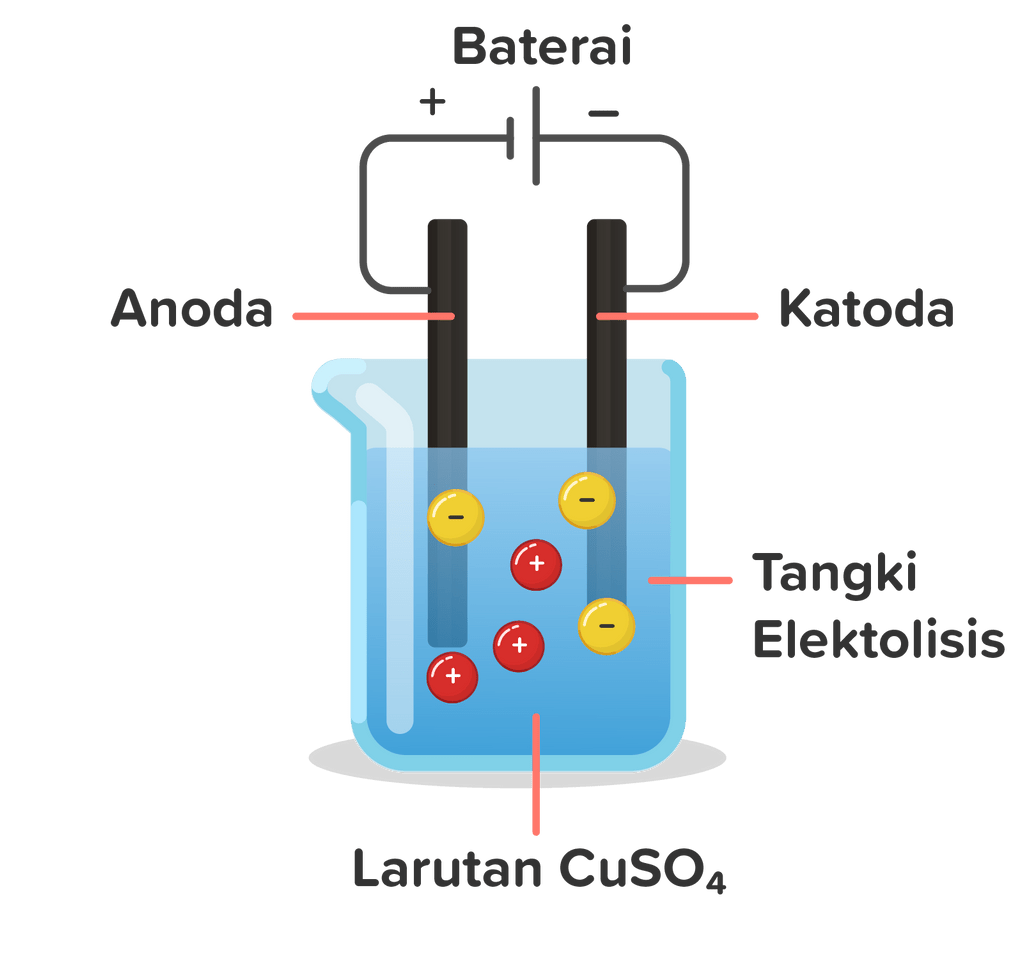
Proses elektrolisis ini berlangsung selama 965 detik dengan menggunakan arus 2 A. Tentukan reaksi yang terjadi di katoda dan anoda serta hitunglah massa logam yang digunakan untuk menyepuh tersebut!
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
9
3.7 (7 rating)
KD
Kayla Dwi Fadliah
Makasih ❤️
la
lili ahyani
Ini yang aku cari! Makasih ❤️
a
asty
Pembahasan lengkap banget
ZA
Zahirotu Afaaf Adilah
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















