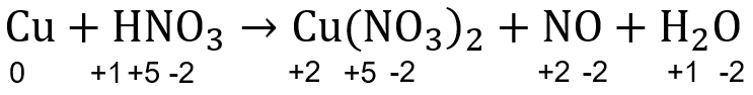Langkah PERTAMA: tentukan biloks setiap unsur yang menyusun senyawa-senyawa dalam persamaan reaksi.
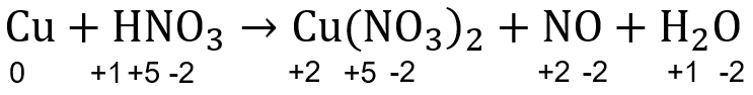
Biloks (ruas kiri) Cu = 0, H = +1, N = +5, O = -2.
Biloks (ruas kanan) Cu = +2, N = +5, O = -2, N = +2, O = -2, H = +1, O = -2.
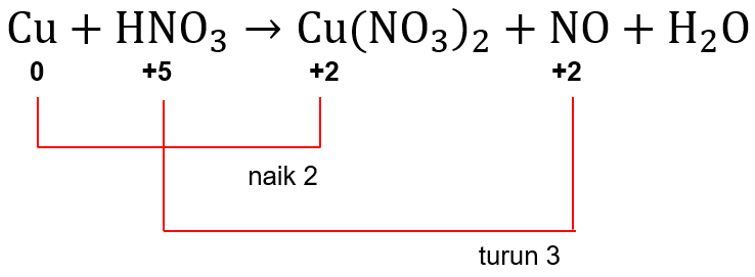
Langkah KEDUA: mengidentifikasi unsur yang mengalami perubahan biloks.
Pada reaksi ini, biloks unsur Cu naik dari 0 menjadi +2. Kemudian, biloks unsur N turun dari +5 menjadi +2.
Langkah KETIGA: menyamakan total perubahan biloks pada reaksi.
Sebelumnya sudah diketahui bahwa total kenaikan biloks Cu adalah 2, sedangkan total penurunan biloks N adalah 3. Agar total perubahan biloksnya sama, maka kita cari kelipatan terkecil yang sama antara 2 dan 3, yaitu 6. Maka dari itu, kenaikan biloks Cu kita kalikan 3, sedangkan penurunan biloks N kita kalikan 2. Agar total perubahan biloksnya sama-sama menjadi 6.
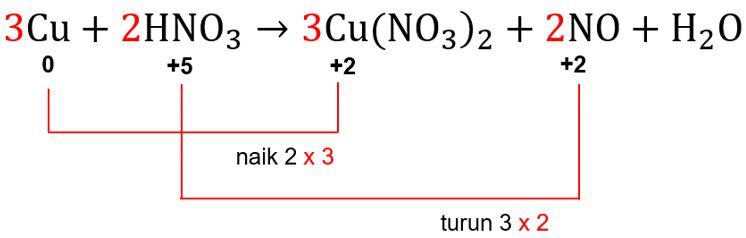
Angka faktor pengali 3 akan menjadi pengali koefisien dari zat yang mengandung unsur Cu, sedangkan angka faktor pengali 2 akan menjadi pengali koefisien dari zat yang mengandung unsur N.
Langkah KEEMPAT: menyamakan jumlah unsur yang belum sama (selain oksigen dan hidrogen)
Pada reaksi ini, jumlah unsur yang belum sama adalah unsur N. Pada ruas kiri terdapat 2 atom N, sedangkan di ruas kanan terdapat 8 atom N. Agar jumlah atom N sama, maka  di ruas kiri kita kalikan 4 dan koefisiennya menjadi 8.
di ruas kiri kita kalikan 4 dan koefisiennya menjadi 8.

Langkah KELIMA: menyamakan jumlah unsur oksigen dan hidrogen, pastikan semua unsur jumlahnya sudah sama di ruas kiri dan kanan.
Di ruas kiri jumlah atom H ada 8, sedangkan di ruas kanan jumlah atom H ada 2. Supaya sama,  di ruas kanan kita kalikan 4.
di ruas kanan kita kalikan 4.

Penyetaraan reaksi tersebut dalam suasana asam yang tepat adalah sebagai berikut.


Jadi, jawaban yang tepat adalah opsi D.