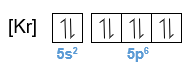Iklan
Pertanyaan
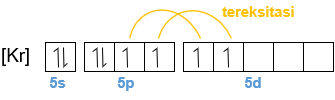
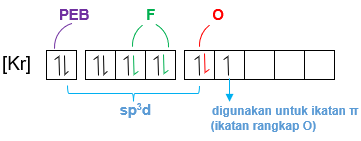
Perhatikan gambar berikut. Senyawa XeOF 2 memiliki molekul dengan bentuk T. Pola dasar dari bentuk molekul tersebut adalah segitiga piramida. Atom pusatnya, yaitu Xe memiliki 5 pasangan elektron pada kulit terluarnya. Sebanyak tiga pasang elektron masing-masing berikatan dengan 2 atom F dan 1 atom O, sedangkan 2 pasang elektron lainnya bebas (tidak berikatan). Oleh karena itu, bentuk molekulnya menjadi bentuk T. Bagaimana sifat kepolaran molekul tersebut? Jelaskan alasannya. Tentukan tipe molekul XeOF 2 . Apakah orbital hibridisasinya? Prediksikan orbital hibridisasi yang lain, tetapi memiliki bentuk molekul yang sama, yaitu bentuk T.
Perhatikan gambar berikut.
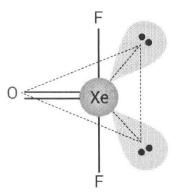
Senyawa memiliki molekul dengan bentuk T. Pola dasar dari bentuk molekul tersebut adalah segitiga piramida. Atom pusatnya, yaitu Xe memiliki 5 pasangan elektron pada kulit terluarnya. Sebanyak tiga pasang elektron masing-masing berikatan dengan 2 atom F dan 1 atom O, sedangkan 2 pasang elektron lainnya bebas (tidak berikatan). Oleh karena itu, bentuk molekulnya menjadi bentuk T.
- Bagaimana sifat kepolaran molekul tersebut? Jelaskan alasannya.
- Tentukan tipe molekul .
- Apakah orbital hibridisasinya?
- Prediksikan orbital hibridisasi yang lain, tetapi memiliki bentuk molekul yang sama, yaitu bentuk T.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
22
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia