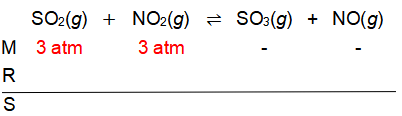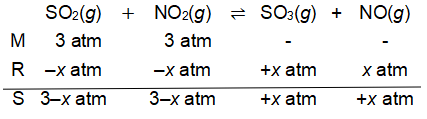Iklan
Pertanyaan
Pada suhu tertentu terjadi reaksi kesetimbangan berikut. SO 2 ( g ) + NO 2 ( g ) ⇌ SO 3 ( g ) + NO ( g ) dengan tetapan kesetimbangan 0,25. Bila pada awal reaksi tekanan parsial gas SO 2 dan NO 2 masing-masing adalah 3,0 atm, maka tekanan parsial gas NO 2 pada keadaan kesetimbangan adalah ....
Pada suhu tertentu terjadi reaksi kesetimbangan berikut.
dengan tetapan kesetimbangan 0,25. Bila pada awal reaksi tekanan parsial gas dan masing-masing adalah 3,0 atm, maka tekanan parsial gas pada keadaan kesetimbangan adalah ....
1,0 atm
1,5 atm
2,0 atm
2,5 atm
3,0 atm
Iklan
MR
M. Rizki
Master Teacher
Jawaban terverifikasi
19
2.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia