Struktur ruang suatu molekul dapat diramalkan berdasarkan adanya Pasangan Elektron lkatan (PEl) dan Pasangan Elektron Bebas (PEB) pada kulit terluar dari atom pusat di dalam molekul tersebut. Pasangan elektron yang terdapat pada kulit terluar dari suatu atom pusat memiliki muatan sejenis sehingga terjadi suatu gaya tolak-menolak. Pasangan-pasangan elektron ini akan memperkecil gaya tolak-menolak tersebut dengan membentuk suatu susunan tertentu. Teori ini dikenal sebagai Teori Tolakan Pasangan Elektron Kulit Valensi atau Teori VSEPR (Valence Shell Electron Pair Repulsion). Senyawa-senyawa yang memiliki pasangan elektron bebas dirumuskan dengan notasi A, X, E, dengan A sebagai atom pusat, X sebagai elektron yang terikat (PEI), dan E merupakan pasangan elektron bebas (PEB).
Struktur Lewis dari senyawa H2O adalah sebagai berikut.
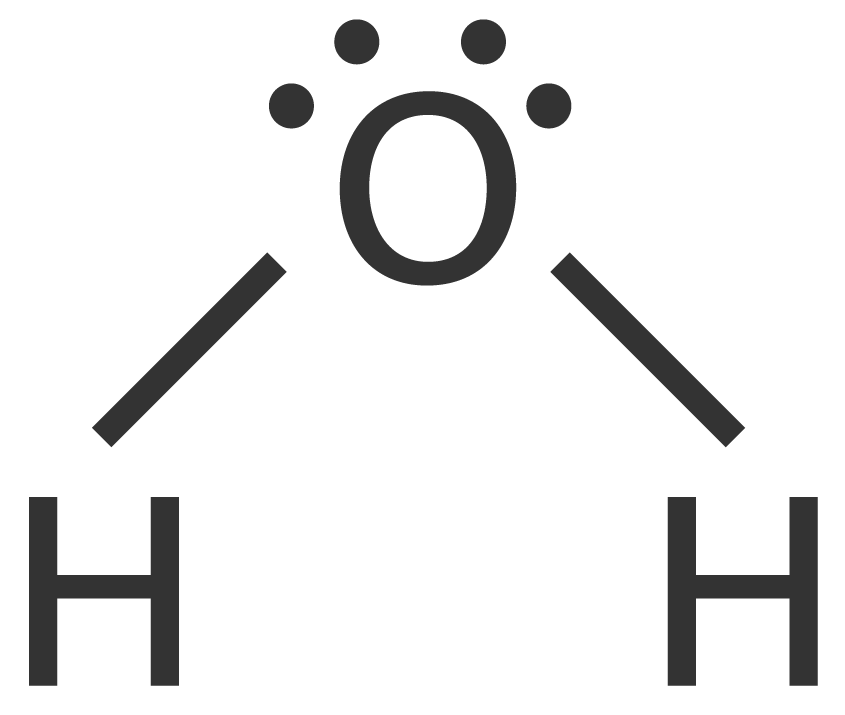
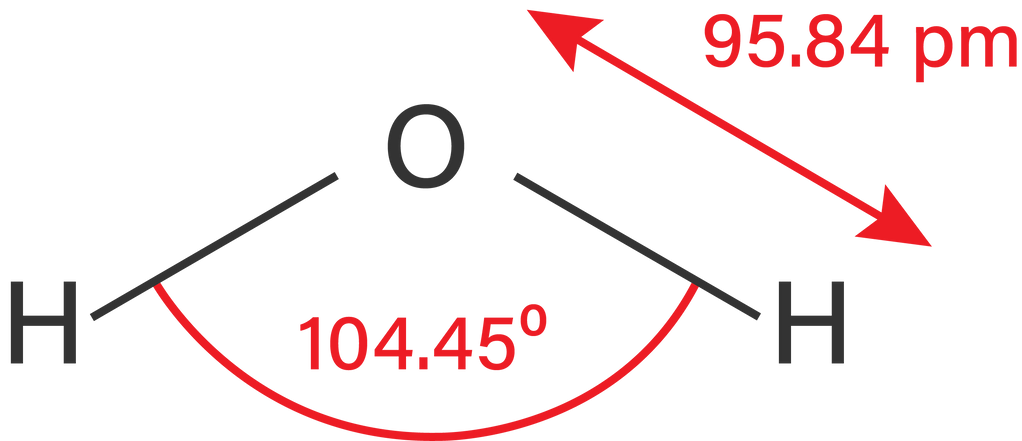
Berdasarkan struktur Lewisnya dapat diketahui bahwa dalam molekul H2O terdapat empat pasangan elektron yang terdiri atas 2 PEl (X) dan 2 PEB (E). Oleh karena itu, molekul H2O memiliki rumus AX2E2 dengan susunan ruang atau bentuk molekul berupa tetrahedral. Akan tetapi, dalam molekul H2O ini terdapat dua PEB sehingga molekul H2O berbentuk seperti huruf "V" atau bentuk sudut. Hal ini disebabkan oleh adanya gaya tolak-menolak dari PEB-PEB ini. Besar sudut ikatan H−O−H pada molekul H2O menjadi 104,5∘. Gambar sudut ikatan pada molekul H2O adalah sebagai berikut.
Bentuk molekul dari senyawa CO2 adalah sebagai berikut.

Berdasarkan struktur Lewis dan bentuk molekulnya dapat diketahui bahwa dalam molekul CO2 terdapat dua pasangan elektron yang terdiri atas 2 PEl (X) yang membentuk ikatan rangkap dua dan tidak terdapat PEB (E). Oleh karena itu, molekul CO2 memiliki rumus AX2 dengan susunan ruang atau bentuk molekulnya berbentuk linier dengan sudut ikatan 180∘.
Dengan demikian, maka perbedaan sudut ikatan antara molekul CO2 dan sudut ikatan H2O disebabkan karena pada molekul H2O memiliki 2 pasangan elektron bebas (PEB) yang memberi gaya tolak-menolak antara kedua PEB-nya sehingga menyebabkan molekul H2O membentuk sudut sebesar 104,5∘.
Jadi, perbedaan sudut ikatan pada molekul H2O dan molekul CO2 disebabkan karena adanya gaya tolak-menolak antara 2 PEB yang terdapat dalam molekul H2O, sedangkan molekul CO2 tidak memiliki PEB. Bentuk molekul H2O dan CO2 berturut-turut adalah sebagai berikut.




















