Bentuk molekul (geometri molekul) adalah kedudukan atom-atom dalam molekul. Geometri molekul dapat diramalkan berdasarkan gaya elektrostatis antar elektron yang terlibat dalam pembentukan ikatan. Pembentukan ikatan antar atom untuk membentuk molekul melibatkan elektron-elektron di kulit terluar. Pada senyawa kovalen, ikatan kimia berupa sepasang elektron yang dipakai bersama sehingga bentuk molekul ditentukan oleh kedudukan pasangan elektron. Bentuk molekul dapat diramalkan dengan lambang atau struktur Lewisnya.
Menurut struktur Lewis, selain sepasang elektron yang digunakan untuk berikatan, juga digambarkan pasangan elektron yang tidak berikatan. Pasangan elektron yang tidak digunakan untuk berikatan disebut pasangan elektron bebas (PEB). Dengan demikian, ada dua jenis pasangan elektron dalam molekul, yaitu pasangan elektron yang digunakan untuk berikatan (PEl) dan pasangan elektron bebas (PEB). Senyawa-senyawa yang memiliki PEB dirumuskan dengan notasi A, X, E dengan A adalah atom pusat, X adalah jumlah elektron yang terikat pada atom pusat, dan E adalah pasangan elektron bebas.
Struktur Lewis dari senyawa  dan
dan  adalah sebagai berikut.
adalah sebagai berikut.
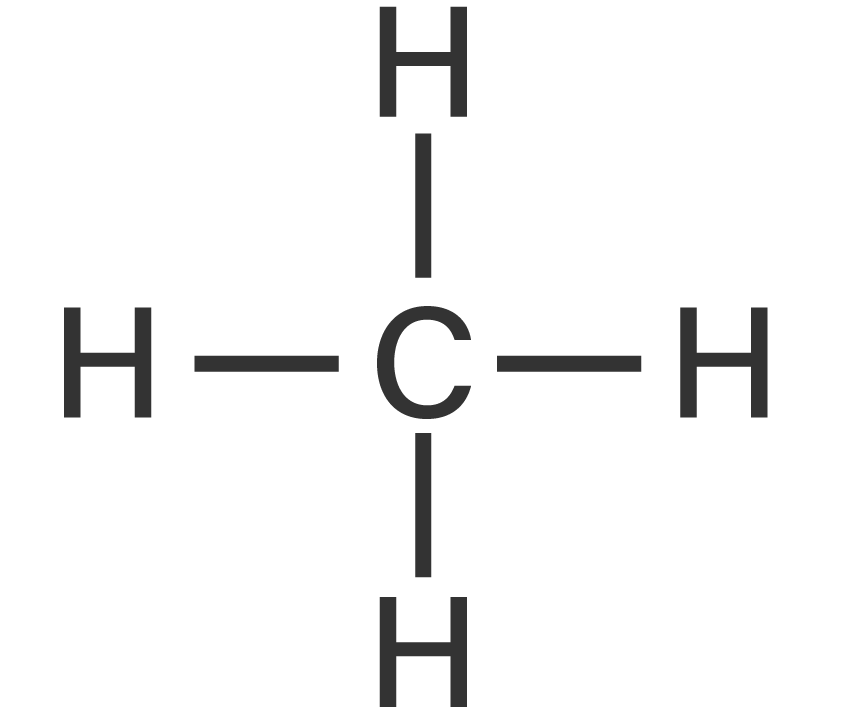
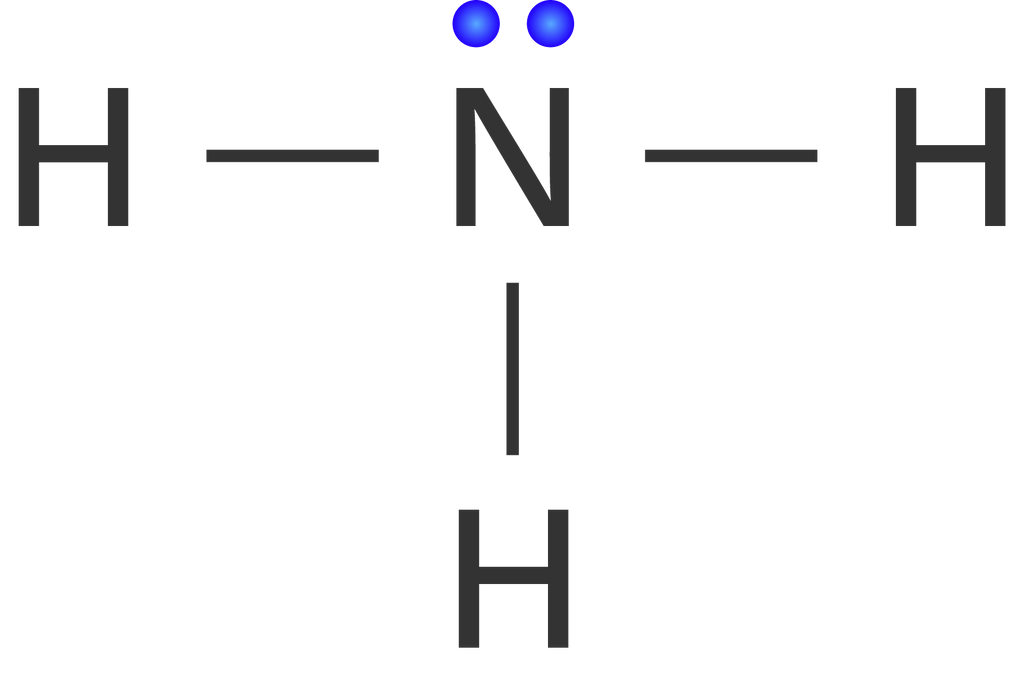
Pada molekul  terdapat empat pasangan elektron yang terdiri atas tiga PEI dan satu PEB. Dengan demikian, molekul
terdapat empat pasangan elektron yang terdiri atas tiga PEI dan satu PEB. Dengan demikian, molekul  memiliki rumus AX3E dengan bentuk molekul piramida trigonal. Besar sudut antar ikatan H−N−H dalam molekul
memiliki rumus AX3E dengan bentuk molekul piramida trigonal. Besar sudut antar ikatan H−N−H dalam molekul  adalah sebesar 107∘, hal ini terjadi akibat adanya gaya tolak-menolak antara PEB dengan PEI. Besar sudut ini lebih kecil dibandingkan dengan sudut ikatan H−C−H dalam molekul
adalah sebesar 107∘, hal ini terjadi akibat adanya gaya tolak-menolak antara PEB dengan PEI. Besar sudut ini lebih kecil dibandingkan dengan sudut ikatan H−C−H dalam molekul  yang memiliki sudut ikatan sebesar 109,5∘ karena pada molekul
yang memiliki sudut ikatan sebesar 109,5∘ karena pada molekul  tidak memiliki PEB yang dapat menimbulkan gaya tolak-menolak antara PEB dengan PEI. Bentuk molekul dari senyawa
tidak memiliki PEB yang dapat menimbulkan gaya tolak-menolak antara PEB dengan PEI. Bentuk molekul dari senyawa  adalah tetrahedral.
adalah tetrahedral.
Gambar bentuk molekul dari  (piramida trigonal) dan bentuk molekul dari
(piramida trigonal) dan bentuk molekul dari  (tetrahedral) adalah sebagai berikut.
(tetrahedral) adalah sebagai berikut.
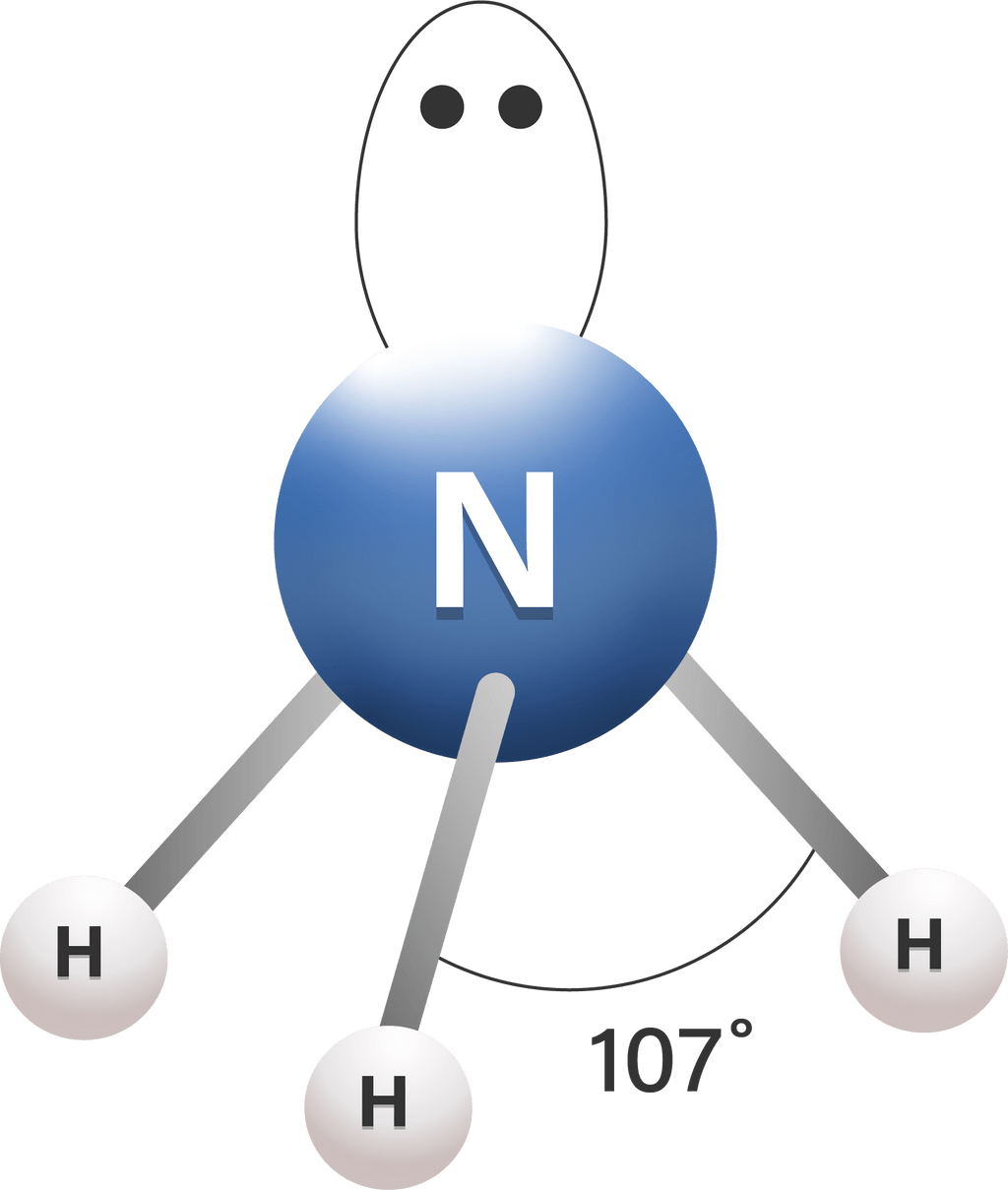
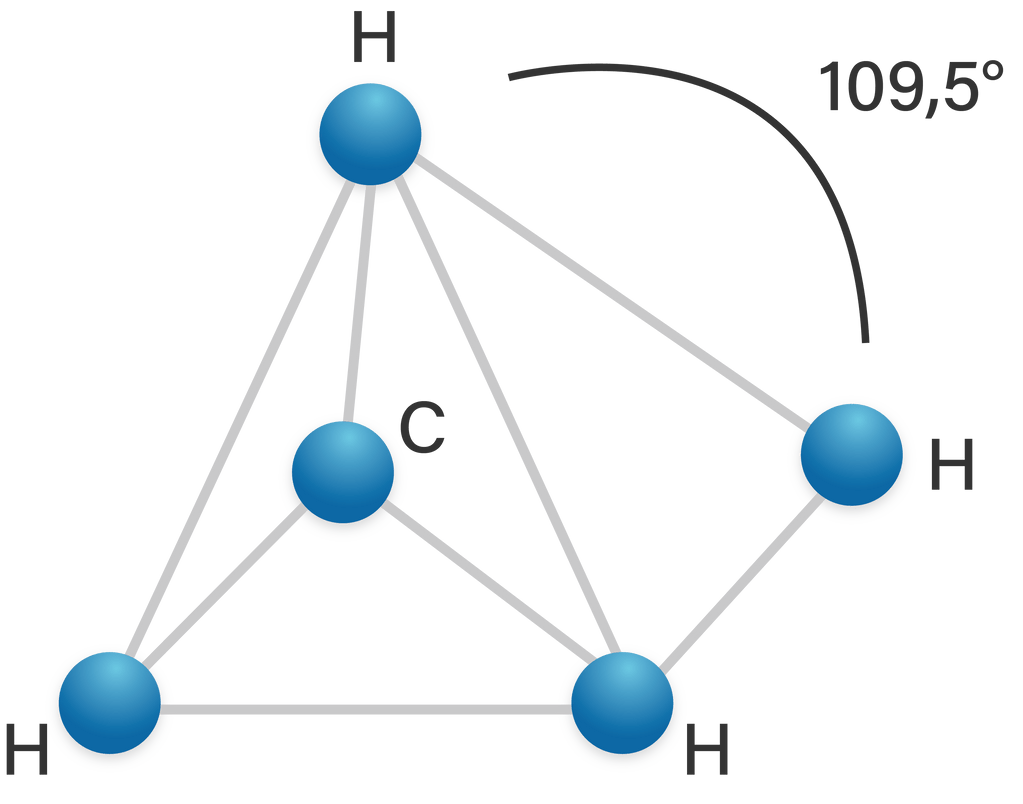
Jadi, perbedaan besar sudut antara senyawa  dengan
dengan  terjadi karena adanya pasangan elektron bebas (PEB) pada
terjadi karena adanya pasangan elektron bebas (PEB) pada  yang menyebabkan adanya gaya tolak-menolak antara PEB dengan PEI. Bentuk molekul
yang menyebabkan adanya gaya tolak-menolak antara PEB dengan PEI. Bentuk molekul  dan
dan  adalah sebagai berikut.
adalah sebagai berikut.





















