Iklan
Pertanyaan
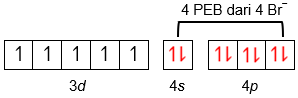
Logam Fe ( Z = 26)dapat berikatan dengan Br − membentuk ion kompleks [ FeBr 4 ] − . Geometri ion kompleks tersebut adalah ....
Logam Fe (Z = 26) dapat berikatan dengan membentuk ion kompleks . Geometri ion kompleks tersebut adalah ....
segitiga planar
segi empat planar
oktahedral
tetrahedral
linear
Iklan
FT
F. Tri
Master Teacher
Jawaban terverifikasi
255
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia