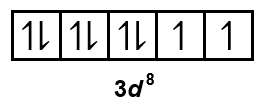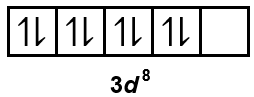Soal tersebut dapat diselesaikan dengan langkah pengerjaan sebagai berikut.
Langkah 1: menuliskan konfigurasi elektron ion logam Ni
Logam Ni memiliki nomor atom 28. Konfigurasi elektron atom logam Ni dapat dituliskan sebagai berikut.
28Ni=[18Ar] 4s2 3d8
Oleh karena ligan NH3 bermuatan netral, muatan ion kompleks sama dengan muatan atom pusatnya, yaitu +2. Dengan demikian, konfigurasi elektron ion Ni2+ dapat dituliskan sebagai berikut.
28Ni2+=[18Ar] 4s0 3d8
Langkah 2: menentukan geometri ion kompleks
Ligan dapat dibedakan menjadi 2 menurut kekuatan ligannya, yaitu ligan kuat dan ligan lemah. Berikut ini adalah urutan kekuatan ligan.
Ligan kuat: CO>CN−>NO2>NH3>SCN−
Ligan lemah: H2O>C2O42−>OH−>F−>Cl−>Br−>I−
Berdasarkan urutan kekuatan ligan, ligan  merupakan ligan kuat. Untuk ligan kuat seperti ligan
merupakan ligan kuat. Untuk ligan kuat seperti ligan  dapat terjadi dua kemungkinan sebagai berikut.
dapat terjadi dua kemungkinan sebagai berikut.
- Jika jumlah elektron yang tidak berpasangan pada atom pusat berjumlah genap, akan mendesak elektron tersebut untuk berpasangan.
- Jika jumlah elektron yang tidak berpasangan nya ganjil, nanti elektron ini mengalami eksitasi ke orbital lain yang kosong.
Diagram orbital valensi ion Ni2+ dapat digambarkan sebagai berikut.
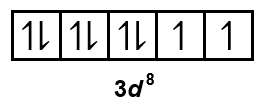
Oleh karena jumlah elektron tidak berpasangannya berjumlah genap, ligan NH3 akan mendesak elektron untuk berpasangan membentuk diagram orbital berikut.
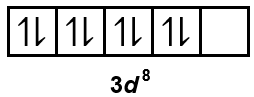
Ligan NH3 merupakan ligan monodentat yang hanya mendonorkan 1 pasang elektron bebas. Oleh karena terdapat 4 ligan NH3, 4 pasangan elektron bebas dari ligan akan mengisi 1 orbital pada sub kulit 3d, 1 orbital pada subkulit 4s, dan 2 orbital pada subkulit 4p sebagai berikut.
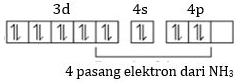
Orbital hibrida yang dibentuk adalah dsp2. Dengan demikian, geometri dari ion kompleks tersebut adalah segi empat planar.
Jadi, jawaban yang tepat adalah A.