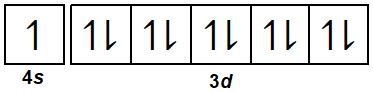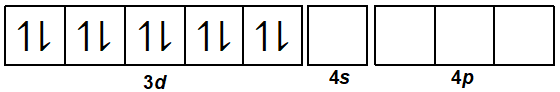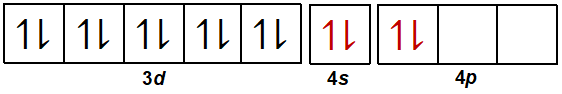Pada hibridisasi ion kompleks, atom pusat harus menyiapkan orbital kosong yang akan ditempati oleh pasangan elektron bebas dari ligan. Ion [Cu(NH3)2]+ menunjukkan bahwa atom pusatnya adalah Cu dengan nomor atom 29. Berikut ini konfigurasi elektron dan diagram orbital atom Cu
29Cu=[18Ar] 4s1 3d10
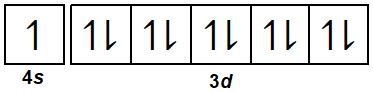
Pada ion kompleks ini, ligannya adalah NH3 yang bermuatan 0. Muatan atom pusatnya dapat dihitung sebagai berikut.
biloks Cu+(2×muatan NH3)biloks Cu+2×(0)biloks Cu===muatan ion kompleks+1+1
Oleh karena ion pusatnya adalah ion Cu+ (lepas 1 elektron), konfigurasi elektron dan diagram orbitalnya menjadi seperti berikut.
29Cu+=[18Ar] 3d10 4s0 4p0
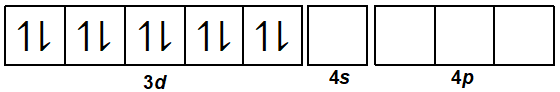
Pada ion kompleks [Cu(NH3)2]+, ion Cu+ akan menerima 2 pasang elektron bebas dari NH3. Oleh karena itu, Cu+ (sebagai ion pusat) harus menyiapkan 2 orbital kosong untuk menerima 2 pasang elektron bebas dari NH3 (sebagai ligan). Dua orbital kosong tersebut dapat diperoleh dari orbital pada kulit terluar, yaitu kulit ke-4 yang dimulai dari 4s kemudian 4p.
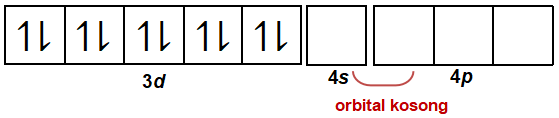
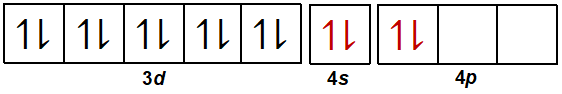
Oleh karena tingkat energi 4s dan 4p berbeda (tingkat energi 4s lebih rendah daripada tingkat energi 4p), nantinya akan terjadi proses hibridisasi sehingga akan membentuk orbital hibrida sp yang memiliki geometri linear.
Jadi, jawaban yang benar adalah B.