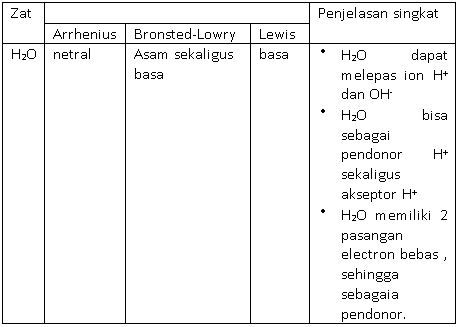
H2O bersifat netral karena dapat melepas ion H+ dan OH− (Arrhenius), bersifat asam maupun basa karena bisa sebagai donor proton sekaligus akseptor proton (Bronsted-Lowry), dan memiliki pasangan elektron bebas sehingga bertindak sebagai basa (Lewis).
Teori asam basa mengalami perkembangan dari masa ke masa oleh beberapa tokoh, diantaranya Arrhenius, Bronsted dan Lowry, serta Lewis.
Teori asam basa Arrhenius:
- asam adalah zat yang dapat melepas ion H+ ketika dilarutkan dalam air
- basa adalah zat yang dapat melepas ion OH− ketika dilarutkan dalam air
H2O murni ketika terionisasi maka akan membentuk ion H+ dan OH− sekaligus. Hal ini menjelaskan bahwa H2O bisa bersifat netral berdasarkan teori Arrhenius.
Teori asam basa Bronsted-Lowry:
- asam adalah zat pendonor proton (H+)
- basa adalah zat penerima proton (H+)
Perhatikan reaksi berikut.
H2O+NH3→NH4++OH− +4mu(1)H2O+HCl→H3O++Cl− (2)
Pada reaksi 1 H2O bertindak sebagai pendonor proton sehingga H2O bertindak sebagai asam menurut teori Bronsted-Lowry. Sedangkan pada reaksi 2 H2O menerima ion H+, sehingga H2O sebagai basa. Artinya H2O sendiri bisa bertindak sebagai asam maupun basa bergantung terhadap apa yang dilarutkan.
Teori asam basa Lewis:
- asam adalah zat penerima pasangan elektron (akseptor)
- basa adalah zat pendonor pasangan elektron (donor)
H2O memilki 2 pasang elektron bebas, sehingga kemungkinan besar dia sebagai pendonor pasangan elektron bebas atau bersifat sebagai basa Lewis.