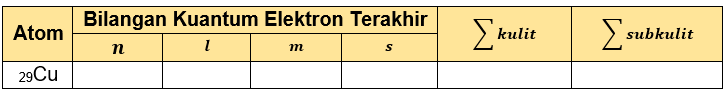
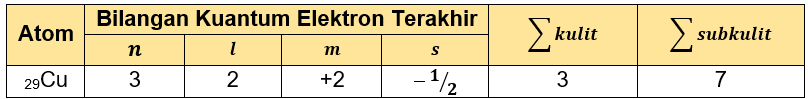
Tabel yang telah lengkap adalah sebagai berikut.
Dalam penentuan keempat bilangan kuantum, diperlukan untuk menentukan elektron terakhir dari konfigurasi elektron terlebih dahulu. Setelah itu elektron terakhir dapat digunakan untuk menentukan bilangan kuantumnya. Terdapat empat jenis bilangan kuantum yaitu:
- Bilangan kuantum utama (n), yang menunjukkan kulit atom.
- Bilangan kuantum azimuth (l), yang menunjukkan subkulit atom.
- Bilangan kuantum magnetik (m), yang menunjukkan orientasi orbital.
- Bilangan kuantum spin (s), yang menunjukkan arah rotasi elektron.
Berdasarkan keterangan tersebut, maka:
Konfigurasi elektron 29Cu adalah
1s22s22p63s23p64s13d10 (mengikuti aturan penuh pada subkulit d), sehingga elektron terakhirnya adalah 3d10. Berdasarkan konfigurasi elektron maka jumlah subkulitnya adalah 7, yaitu 4 subkulit s, 2 subkulit p, dan 1 subkulit d.
Bilangan kuantum 3d10
Bilangan kuantum utama atau n = 3, bilangan kuantum utama menunjukkan jumlah kulit. Jadi jumlah kulitnya adalah 3.
Bilangan kuantum azimuth atau l = 2, karena berada pada subkulit "d".
Bilangan kuantum magnetik dan azimuth:
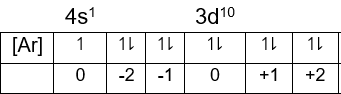
Elektron terakhir ada pada subkulit 3d orbital "+2" dengan arah ke bawah, maka nilai:
m = 0 dan s = −21
Dengan demikian, tabel tersebut dapat dilengkapi: