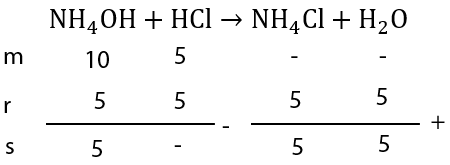Iklan
Pertanyaan
Larutan NH 4 OH 0,2 M sebanyak 50 mL dicampur dengan 100 mL larutan HCl 0,05 M. Jika K b NH 4 OH = 1 0 − 5 maka pH larutan yang terbentuk adalah ....
Larutan 0,2 M sebanyak 50 mL dicampur dengan 100 mL larutan HCl 0,05 M. Jika maka pH larutan yang terbentuk adalah ....
Iklan
SH
S. Hidayati
Master Teacher
Mahasiswa/Alumni Universitas Indonesia
Jawaban terverifikasi
14
4.7 (14 rating)
RG
Rama Gaming
Makasih ❤️
JN
Jessica Ndarung
Pembahasan lengkap banget Mudah dimengerti Bantu banget Ini yang aku cari! Makasih ❤️
Da
Dimas andrean Ks
Pembahasan tidak lengkap
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia