Iklan
Pertanyaan
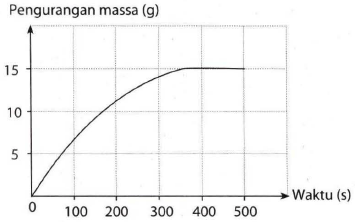
Kalsium karbonat (pualam) bereaksi dengan asam klorida menurut persamaan reaksi berikut: CaCO 3 ( s ) + 2 HCl ( a q ) → CaCl 2 ( a q ) + H 2 O ( l ) + CO 2 ( g ) Laju reaksi ini dapat ditentukan dengan mengukur pengurangan massa campuran. Salah satu hasil percobaan tersebut dapat dilihat pada grafik berikut: Jelaskan mengapa massa campuran berkurang terhadap waktu.
Kalsium karbonat (pualam) bereaksi dengan asam klorida menurut persamaan reaksi berikut:
Laju reaksi ini dapat ditentukan dengan mengukur pengurangan massa campuran. Salah satu hasil percobaan tersebut dapat dilihat pada grafik berikut:
Jelaskan mengapa massa campuran berkurang terhadap waktu.
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
2
3.5 (2 rating)
w
wawa
Bantu banget Ini yang aku cari!
FL
Feby Le
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia