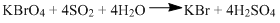Iklan
Pertanyaan
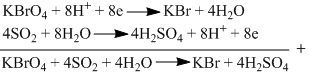
Kalium perbromat dapat mengoksidasi belerang(IV) oksida menjadi asam sulfat sesuai persamaan kimia (belum setara): KBrO 4 + SO 2 + H 2 O → KBr + H 2 SO 4 Dalam suatu percobaan digunakan 100 mL larutan KBrO 4 yang merupakan hasil pengenceran 5 mL KBrO 4 1 M untuk mengoksidasi larutan 50 mL SO 2 . Setelah reaksi, larutan dalam labu titrasi diencerkan dengan menambahkan 50 mL air murni. Konsentrasi SO 2 dalam larutan semula adalah .... (Tipe Soal UTBK 2019)
Kalium perbromat dapat mengoksidasi belerang(IV) oksida menjadi asam sulfat sesuai persamaan kimia (belum setara):
Dalam suatu percobaan digunakan 100 mL larutan yang merupakan hasil pengenceran 5 mL 1 M untuk mengoksidasi larutan 50 mL . Setelah reaksi, larutan dalam labu titrasi diencerkan dengan menambahkan 50 mL air murni.
Konsentrasi dalam larutan semula adalah ....
(Tipe Soal UTBK 2019)
0,1 M
0,2 M
0,3 M
0,4 M
0,5 M
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia