Jawaban yang tepat adalah opsi D.
Cara penyetaraan persamaan reaksi redoks dapat dilakukan dengan dua cara, yaitu cara setengah reaksi dan cara perubahan bilangan oksidasi. Cara penyetaraan persamaan reaksi redoks dengan cara setengah reaksi yaitu dengan melihat elektron yang diterima atau dilepaskan, kemudian menyamakan jumlah elektronnya. Cara ini diutamakan untuk reaksi dengan suasana reaksi telah diketahui. Cara penyetaraan persamaan reaksi dengan cara perubahan bilangan oksidasi yaitu dengan cara melihat perubahan bilangan oksidasinya, kemudian menyamakan perubahan bilangan oksidasi tersebut.
Persamaan reaksi antara KMnO4 bereaksi dengan H2C2O4 dituliskan sebagai berikut.
KMnO4+H2C2O4→MnSO4+CO2
Sebelum menentukan jumlah mol elektron yang diterima KMnO4, maka perlu disetarakan persamaan reaksinya dengan cara perubahan bilangan oksidasi sebagai berikut.
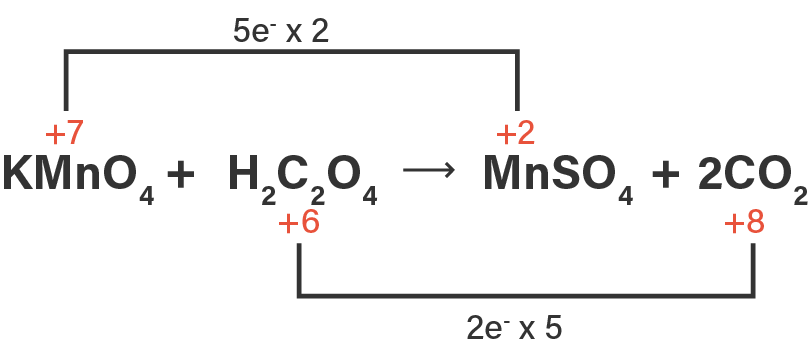
Pada persamaan reaksi di atas, atom C mengalami kenaikan biloks sebanyak 2, sedangkan atom Mn mengalami penurunan biloks sebanyak 5. Untuk menyamakan perubahan biloks keduanya, maka pada reaksi oksidasi reaksinya dikalikan 5, sedangkan pada reaksi reduksi reaksinya dikalikan 2 agar jumlah perubahan biloksnya sama dengan 10. Setelah dikalikan dengan bilangan pengalinya, maka persamaan reaksinya menjadi seperti berikut.
2KMnO4+5H2C2O4→2MnSO4+5CO2
Berdasarkan koefisien dari persamaan reaksi di atas, diketahui bahwa 2 mol KMnO4 mengikat 10 elektron agar tereduksi menjadi MnSO4, maka jika 1 mol KMnO4 tereduksi akan mengikat 5 mol elektron.
Dengan demikian, maka dalam reaksi redoks pada soal, 1 mol KMnO4 menerima 5 mol elektron.