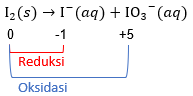Iklan
Pertanyaan
Reaksi disproporsionasi iodium ( I 2 ) dalam suasana basa berlangsung sebagai berikut. 3 I 2 ( s ) + 6 KOH ( a q ) → 5 KI ( a q ) + KIO 3 ( a q ) + 3 H 2 O ( l ) Jumlah mol elektron yang terlibat pada disproporsionasi 3 mol iodium adalah .... (SBMPTN 2018)
Reaksi disproporsionasi iodium dalam suasana basa berlangsung sebagai berikut.
Jumlah mol elektron yang terlibat pada disproporsionasi 3 mol iodium adalah ....
(SBMPTN 2018)
3
4
5
6
7
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.5 (6 rating)
Ff
Faiz fadhillah
Maaf kak yang atas kepencet rating 2 :( Makasih ❤️
MF
M Faiz Anhari Fadhillah
Pembahasan tidak lengkap
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia