Iklan
Pertanyaan
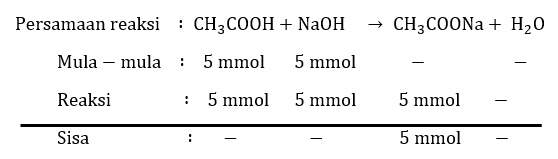
Jika 50 mL CH 3 COOH 0,1 M dititrasi dengan 50 mL NaOH 0,1 M, tentukanlah pH pada titik akhir titrasi dan sifat larutan! ( K a CH 3 COOH = 1 0 − 5 ) .
Jika 50 mL 0,1 M dititrasi dengan 50 mL NaOH 0,1 M, tentukanlah pH pada titik akhir titrasi dan sifat larutan! .
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
5
5.0 (1 rating)
EF
Eka Fatmawati
Pembahasan lengkap banget,Ini yang aku cari! Mudah dimengerti, membantu banget deh, terimakasih❤
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia