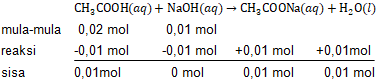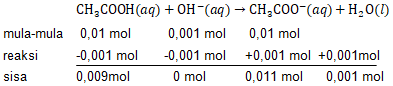Iklan
Pertanyaan
Jika 100 mL larutan CH 3 COOH 0,2 M direaksikan dengan 100 mL larutan NaOH 0,1 M, hitunglah: pH larutan setelah bereaksi ( K a = 1 0 − 5 ), pH larutan, jika larutan hasil reaksi diatas ditambahkan 10 mL larutan NaOH 0,1 M.
Jika 100 mL larutan 0,2 M direaksikan dengan 100 mL larutan 0,1 M, hitunglah:
- pH larutan setelah bereaksi (),
- pH larutan, jika larutan hasil reaksi diatas ditambahkan 10 mL larutan NaOH 0,1 M.
Iklan
VS
V. Seftari
Master Teacher
Mahasiswa/Alumni Universitas Pendidikan Indonesia
Jawaban terverifikasi
1
5.0 (1 rating)
S1
Satria 13
Bantu banget Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia