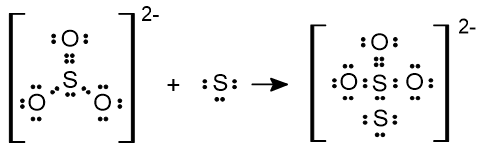Iklan
Pertanyaan
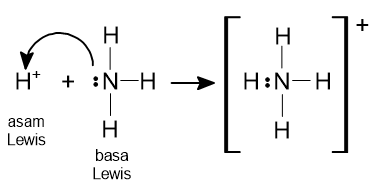
Jelaskan pengertian asam-basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikan dua contoh masing-masing.
Jelaskan pengertian asam-basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikan dua contoh masing-masing.
Iklan
AG
A. Ghifari
Master Teacher
Jawaban terverifikasi
50
4.8 (8 rating)
NF
Nabila Febriani
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia



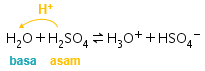 ,
, 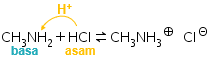 ;
;