Keberadaan ligan pada ion kompleks ini memegang peran penting dalam hal geometri ion kompleks. Hal ini dapat terjadi, karena adanya perbedaan kekuatan ligan. Ligan itu dibedakan menjadi 2, ada ligan kuat dan juga ada ligan lemah.
Ligan kuat

Ligan lemah

Ligan CN− merupakan ligan kuat yang dapat mengalami dua kemungkinan berikut.
- Jika jumlah elektron tidak berpasangan pada atom pusat berjumlah genap, ligan kuat mendesak elektron tersebut untuk berpasangan.
- Jika jumlah elektron tidak berpasangannya ganjil, elektron ini mengalami eksitasi ke orbital lain yang kosong.
Penentuan biloks atom pusat dapat menggunakan persamaan berikut.
muatan kompleks−3biloks Co===muatan ligan+biloks atom pusat6×(−1)+biloks Co+3
Pada ion Co3+ yang memiliki jumlah elektron yang tidak berpasangan sebanyak 4 (genap), elektron didesak untuk berpasangan membentuk konfigurasi berikut.
27Co = [18Ar] 4s2 3d7
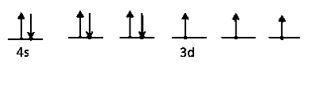
27Co3+ = [18Ar] 4s0 3d6
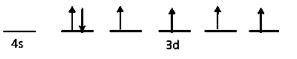
Selanjutnya, elektron yang tidak berpasangan akan didesak untuk berpasangan.
27Co3+ = [18Ar] 3d6 4s0 4p0
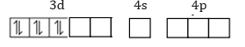
Terdapat 2 orbital kosong pada orbital 3d sehingga pasangan elektron dari ligan CN− yang merupakan ligan kuat akan menempati 2 orbital kosong yang dimiliki oleh ion Co3+ tersebut. Empat ligan sisa akan mengisi 1 orbital 4s dan 3 orbital 4p yang terhibridisasi membentuk orbital hibrida d2sp3 yang memiliki geometri oktahedral.

Jadi, jawaban yang benar adalah C.



















