Dalam penentuan bentuk geometri molekul, diperlukan struktur lewis dari senyawa tersebut untuk menentukan jumlah PEI dan PEB. PEI adalah pasangan elektron yang digunakan untuk berikatan sedangkan PEB adalah pasangan elektron bebas yang tidak digunakan untuk berikatan. Rumus umum tipe molekul adalah AXE, dengan A adalah atom pusat X jumlah PEI dan E jumlah PEB.
Untuk mengetahui bentuk molekul AlCl3 dan PH3 maka perlu menentukan struktur lewis dari molekul-molekul tersebut.
Konfigurasi elektron Al, Cl, P dan H
13Al=2 8 3 (elektron valensi 3)
17Cl=2 8 7 (elektron valensi 7)
1H=1 (elektron valensi 1)
15P=2 8 5 (elektron valensi 5)
a. Bentuk molekul AlCl3
Menentukan struktur lewis AlCl3:
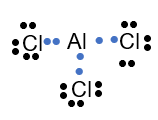
AlCl3 memiliki 3 PEI (dot berwarna biru) dan tidak memiliki PEB, sehingga tipe molekulnya adalah AX3 dan bentuk molekulnya adalah segitiga sama sisi.
b. Bentuk molekul PH3
Menentukan struktur lewis PH3:
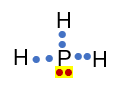
PH3 memiliki 3 PEI (dot berwarna biru) dan 1 PEB (dot berwarna merah), sehingga tipe molekulnya adalah AX3E dan bentuk molekulnya adalah piramida trigonal.
c. Struktur keduanya berbeda karena memiliki tipe molekul yang berbeda.
Tipe molekul memiliki rumus umum AXE, dengan A adalah atom pusat X jumlah PEI dan E jumlah PEB. Seperti yang telah digambarkan pada struktur lewis AlCl3 memiliki 3 PEI dan tidak memiliki PEB; sedangkan PH3 memiliki 3 PEI dan 1 PEB. Ada tidaknya PEB iitulah yang menyebabkan bentuk molekul AlCl3 dan PH3 berbeda. PEB memiliki gaya tolak menolak lebih besar daripada PEI sehingga PEB menempati ruang yang lebih luas daripada PEI.
Jadi, bentuk molekul AlCl3 adalah segitiga sama sisi; bentuk molekul PH3 adalah piramida trigonal; bentuk keduanya berbeda karena PH3 memiliki 1 PEB sedangkan AlCl3 tidak.

















