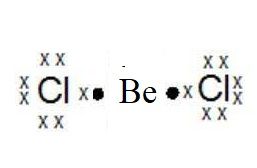Bentuk molekul dapat diketahui dengan teori VSEPR dan teori domain elektron. Pada teori domain elektron yang dilakukan untuk mengetahui bentuk molekul adalah dengan menentukan domain elektron ikatan dan domain elektron bebas. Ikatan kovalen tunggal, ranggap dua, dan rangkap tiga dianggap sebagai satu domain elektron ikatan, sedangkan 1 pasangan elektron bebas dianggap sebagai satu domain elektron bebas. Untuk menentukan hal tersebut maka langkahnya adalah sebagai berikut.
Langkah 1. Menuliskan konfigurasi elektron untuk setiap unsur.
4Be=1s2 2s217Cl=[Ne] 3s2 3p5
Langkah 2. Menggambarkan struktur lewis untuk molekul BeCl2
Pada molekul tersebut, elektron valensi untuk Be adalah 2 sedangkan Cl adalah 7, Be seharusnya akan melepaskan 2 buah elektron untuk memenuhi aturan duplet, tetapi pada molekul ini terjadi pengecualian aturan oktet/duplet sehingga khusus untuk Be pada senyawa BeCl2tidak memilki elektron valensi 2 atau 8 setelah berikatan dengan Cl akan membutuhkan 1 elektron. Meskipun tidak memenuhi aturan oktet/duplet pada kenyataannya molekul ini tetap ada dengan ikatan kovalen sehingga struktur lewisnya adalah:
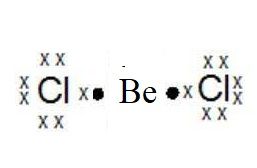
Langkah 3. Menentukan jumlah domain elektron ikatan dan domain elektron bebas pada atom pusat
Berdasarkan gambaran tersebut, terdapat 2 Domain Elektron Ikatan yang ditandai dengan pasangan elektron yang disimbolkan dengan titik dan silang. Sedangkan Domain Elektron Bebas pada atom pusat tidak ada pada molekul ini.
Langkah 4. Menentukan rumus domain ikatan dan bentuk molekul.
Rumus domain ikatan dituliskan dengan format
AXnEm
dengan keterangan:
A = simbol atom pusat
X = simbol domain elektron ikatan
n = jumlah domain elektron ikatan
E = simbol domain elektron bebas
m = jumlah domain elektron bebas
Sehingga rumus domain elektronnya adalah AX2E0, domain elektron tersebut bentuk molekulnya adalah linear.
Jadi, bentuk molekul BeCl2 adalah linear.