Iklan
Pertanyaan
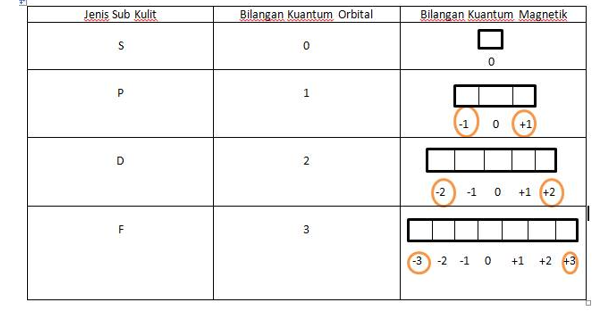
Harga keempat bilangan kuantum untuk elektron terakhir dari 17 Cl adalah ...
Harga keempat bilangan kuantum untuk elektron terakhir dari 17Cl adalah ...
n = 3 ; l = 1 ; m = +1 ; dan s = -1/2
n = 3 ; l = 1 ; m = 0 ; dan s = +1/2
n = 3 ; l = 1 ; m = 0 ; dan s = -1/2
n = 3 ; l = 2 ; m = 0 ; dan s = +1/2
n = 2 ; l = 1 ; m = +1 ; dan s = -1/2
Iklan
MF
M. Firdhaus
Master Teacher
Mahasiswa/Alumni Universitas Jember
Jawaban terverifikasi
23
4.4 (15 rating)
SC
Syakira Chacha
Makasih ❤️
RR
Rafaella Regita
Pembahasan lengkap banget
AC
Adella Chaeyongi
Bantu banget
AF
Allysa Febriani
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia