Perkiraan bentuk molekul dari ion ICl4− dengan menggunakan teori pasangan elektron adalah segiempat planar.
Bentuk molekul (geometri molekul) adalah kedudukan atom-atom dalam molekul. Pembentukan ikatan antar atom untuk membentuk molekul melibatkan elektron-elektron di kulit terluar. Bentuk molekul dapat diramalkan dengan lambang atau struktur Lewisnya.
Menurut struktur Lewis, terdapat dua jenis pasangan elektron dalam molekul, yaitu pasangan elektron yang digunakan tintuk berikatan (PEl) dan pasangan elektron bebas (PEB). Untuk penyederhanaan, rumus molekul yang memiliki pasangan elektron bebas ditulis dengan rumus AXE, dengan A adalah atom pusat, X adalah jumlah elektron yang terikat pada atom pusat, dan E adalah pasangan elektron bebas.
Untuk dapat menjawab soal di atas, maka terlebih dahulu perlu dibuat struktur Lewis senyawanya. Sebelum menentukan struktur Lewis, maka dibuat juga konfigurasi elektron dari unsur-unsur penyusun senyawanya. Ion ICl4− terdiri dari unsur iodin (I) dan klorin (Cl). Konfigurasi elektron kedua unsur tersebut adalah sebagai berikut.
17Cl53I==[10Ne] 3s2 3p5[36Kr] 5s2 4d10 5p5
Berdasarkan konfigurasi elektronnya, dapat diketahui bahwa unsur I dan Cl keduanya memiliki elektron valensi berjumlah 7. Pada ion ICl4−, unsur I berikatan dengan 4 buah atom Cl dan membentuk ion dengan muatan -1. Dengan demikian, maka 4 buah elektron valensi unsur I berikatan dengan masing-masing 1 buah elektron valensi atom F yang membutuhkan 1 elektron untuk mencapai kestabilan. Atom I juga mencapai kestabilan dengan menyerap 1 buah elektron dan membentuk ion dengan muatan -1. Struktur Lewis dari ion ICl4− adalah sebagai berikut.
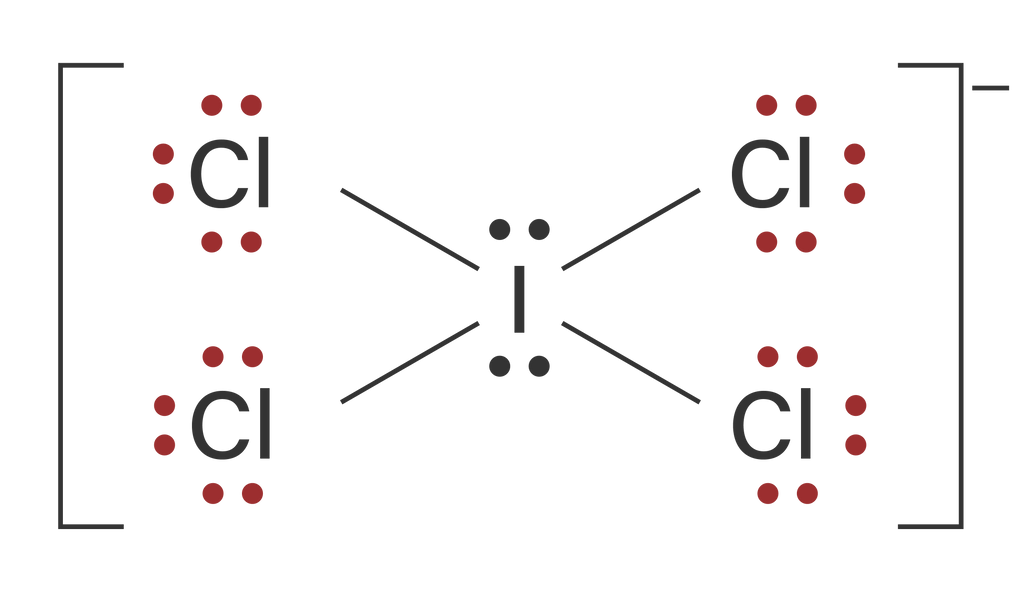
Berdasarkan struktur Lewis di atas, dapat diketahui bahwa pada atom pusat, yaitu I 4 buah elektronnya telah digunakan berikatan kovalen, dan memiliki 2 pasang elektron bebas (PEB). Dengan demikian rumus AXE-nya adalah AX4E2 dan akan memiliki bentuk molekul segiempat planar.
















