Iklan
Pertanyaan
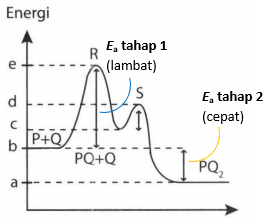
Grafik berikut adalah diagram energi untuk suatu reaksi yang berlangsung dua tahap. Reaksi tahap kedua berlangsung lebih cepat dibandingkan tahap pertama. Pernyataan yang mendukung pernyataan tersebut adalah .... (SOAL SBMPTN 2019)
Grafik berikut adalah diagram energi untuk suatu reaksi yang berlangsung dua tahap.
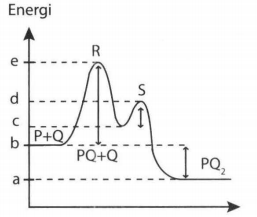
Reaksi tahap kedua berlangsung lebih cepat dibandingkan tahap pertama. Pernyataan yang mendukung pernyataan tersebut adalah ....
(SOAL SBMPTN 2019)
Energi kinetik yang diperlukan untuk terjadinya reaksi pada tahap pertama lebih besar dibandingkan pada tahap kedua.
Tumbukan pada reaksi tahap kedua lebih sering terjadi dibandingkan pada tahap pertama.
Semua tumbukan pada reaksi tahap kedua menghasilkan produk, sedangkan reaksi pada tahap pertama tidak.
Energi kinetik partikel pereaksi pada reaksi tahap pertama lebih kecil dibanding energi kinetik partikel pereaksi pada tahap kedua.
Partikel-partikel pereaksi pada reaksi tahap pertama lebih sedikit dibanding partikel pereaksi pada tahap kedua.
Iklan
S. Lubis
Master Teacher
3
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia