Iklan
Pertanyaan
Gambar berikut menunjukkan profil energi untuk reaksi A + B → C . Pernyataan yang benar sesuai dengan grafik tersebutadalah ....
Gambar berikut menunjukkan profil energi untuk reaksi .
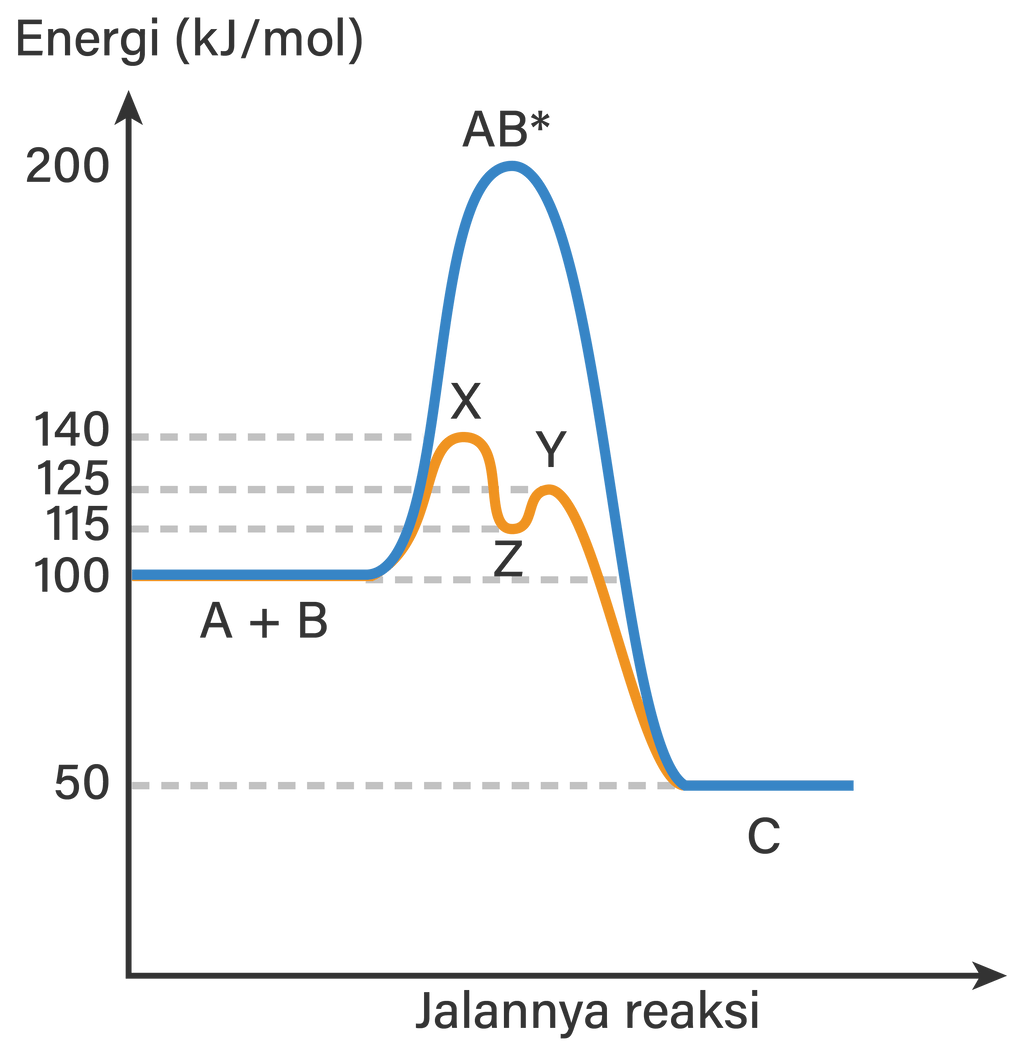
Pernyataan yang benar sesuai dengan grafik tersebut adalah ....
Pembentukan produk C dari A + B termasuk reaksi endoterm.
Pembentukan produk C tanpa katalis terjadi melalui dua tahap reaksi.
Zat AB* merupakan zat hasil antara pada pembentukan C dari A + B.
Pembentuan C dari Z berlangsung lebih lambat dibandingkan pembentukan Z dari A + B.
Tetapan laju reaksi lebih kecil dibandingkan tetapan laju reaksi .
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















