Iklan
Pertanyaan
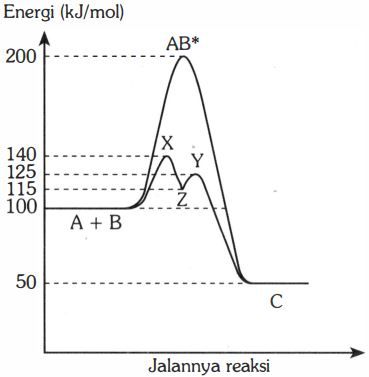
Gambar berikut menunjukkan profil energi untuk reaksi A + B → C . Berdasarkan grafik tersebut, pernyataan yang benar adalah ....
Gambar berikut menunjukkan profil energi untuk reaksi .
Berdasarkan grafik tersebut, pernyataan yang benar adalah ....
Pada pembentukan Z dibebaskan kalor sebesar 15 kJ.
Pada pembentukan C tanpa katalis diserap kalor sebesar 150 kJ.
Energi aktivasi yang merupakan penentu laju reaksi dengan katalis sebesar 40 kJ.
Energi aktivasi balik pada reaksi tanpa katalis sebesar 50 kJ.
Selisih energi aktivasi reaksi tanpa katalis dan reaksi dengan katalis sebesar 60 kJ.
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia