Langkah 1: Tentukan jumlah elektron valensi masing-masing atom dan jumlahnya termasuk muatan 

Langkah 2: Tentukan jumlah elektron valensi tiap atom dan jumlahnya jika memenuhi aturan oktet

Langkah 3: Menghitung selisih elektron valensi oktet dengan elektron valensi sebenarnya
Selisih elektron valensi = 32 – 24 = 8 elektron valensi
Langkah 4: menghitung jumlah ikatan dengan membagi dua selisih elektron valensi
Jumlah ikatan = 8 : 2 = 4 ikatan
Langkah 5: Menggambarkan struktur lewis dengan 4 ikatan kimia berdasarkan aturan oktet.

Langkah 6: Menentukan atom manakah yang bermuatan.
Terlihat bahwa dua buah atom O yang ada di kanan dan kiri atom C memiliki kelebihan elektron valensi. Seharusnya atom O hanya memiliki 6 elektron valensi sedangkan dari strutur lewis terlihat atom O memiliki 7 elektron valensi. Jadi dua buat atom O tersebut masing-masing bermuatan -1 dan muatan totalnya adalah -2. Sehingga struktur lewisnya adalah
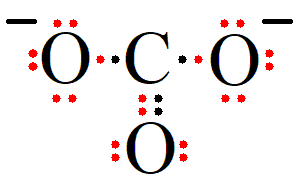
Langkah 7: Menentukan muatan formal





Dengan demikian, struktur lewis dari  adalah yang tertera diatas dan muatan formal dari struktur lewis
adalah yang tertera diatas dan muatan formal dari struktur lewis  adalah -2.
adalah -2.

















