Iklan
Pertanyaan
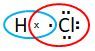
Hidrogen bereaksi dengan klor membentuk hidrogen klorida, HCl. Tulis struktur Lewis pada HCl! Ikatan apa yang terdapat pada HCl? Sebutkan sifat HCl akibat ikatannya!
Hidrogen bereaksi dengan klor membentuk hidrogen klorida, HCl.
- Tulis struktur Lewis pada HCl!
- Ikatan apa yang terdapat pada HCl?
- Sebutkan sifat HCl akibat ikatannya!
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
4
3.0 (2 rating)
IW
Inggrit Wiliyanti
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia