Jika suatu molekul memiliki bentuk segitiga planar (segitiga datar), atom-atom tertata dalam bidang datar, dimana tiga atom berada dalam titik sudut segitiga sama sisi dan di pusat segitiga terdapat atom pusat (ada 3 pasangan elektron ikatan). Sudut ikatan antaratom yang mengelilingi atom pusat membentuk sudut 120∘. Contoh senyawa yang memiliki bentuk molekul segitiga planar adalah BCl3, BF3, serta AlF3, gambarnya adalah sebagai berikut:
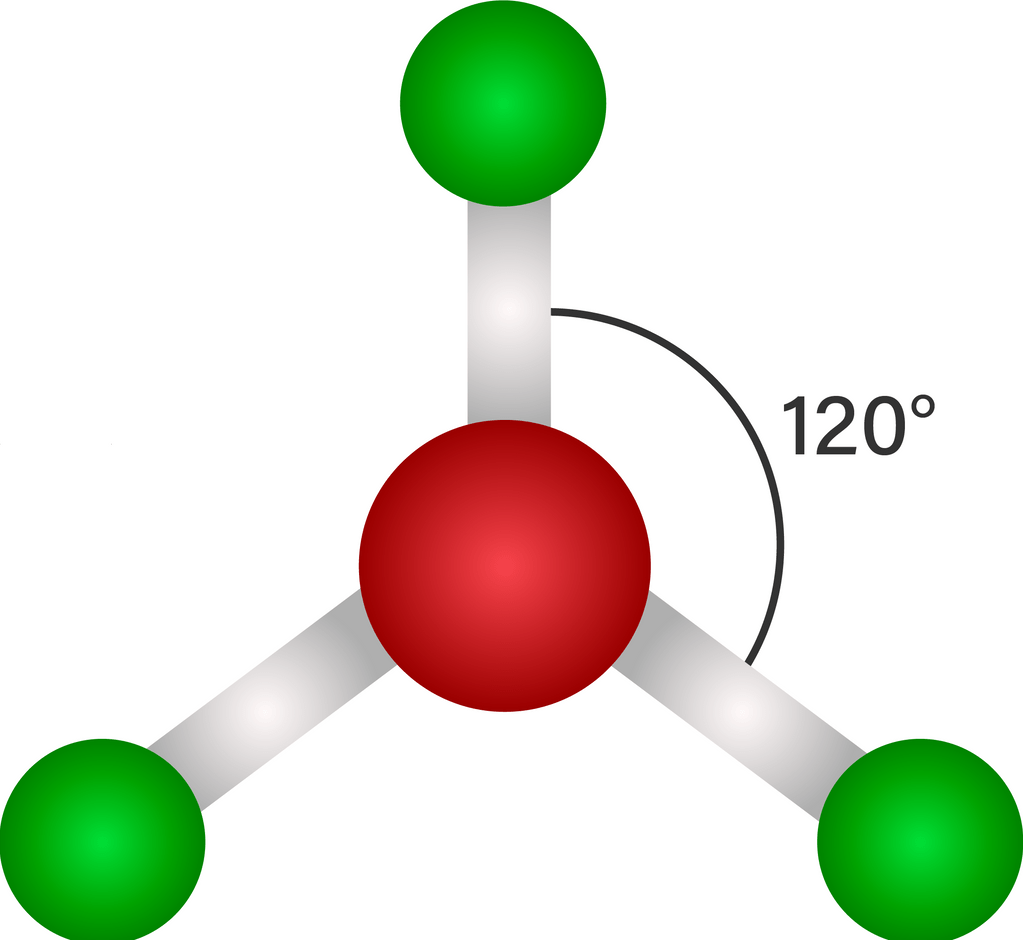
Sedangkan bentuk molekul segitiga piramida, merupakan perluasan dari bentuk tetrahedral. Atom-atom tertata dalam ruang tiga dimensi dengan posisi tiga atom pada titik sudut segitiga, sementara atom pusatnya berada di tengah segitiga namun posisinya lebih tinggi (sehingga bentuknya seperti piramida/kerucut), karena adanya pasangan elektron bebas pada bagian atas. Berdasarkan teori VSEPR gaya tolak pasangan elektron bebas (PEB) lebih kuat dari gaya tolak pasangan elektron ikatan (PEI), sehingga PEB menempati ruang yang lebih luas daripada PEI. Dengan demikian terdapat 4 domain elektron, namun sudut ikatnya (107∘) berbeda dari tetrahedral (109,5∘). Berikut adalah gambar bentuk molekul segitiga piramida.
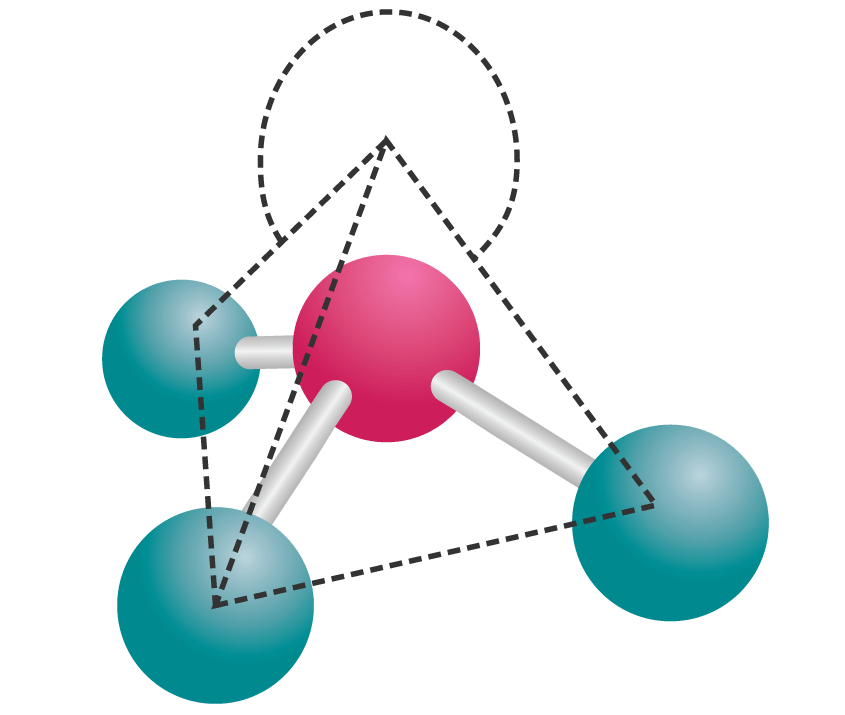
Contoh senyawa yang memiliki bentuk molekul segitiga piramida adalah NH3 dan PCl3.
Jadi, perbedaan kedua bentuk tersebut adalah dari besarnya sudut ikat, jumlah domain elektron atom pusat, dan posisi atom-atom pada molekul tersebut; contoh senyawa dengan bentuk molekul segitiga planar adalah BCl3, BF3, serta AlF3, sedangkan untuk bentuk segitiga piramida NH3 dan PCl3.

















