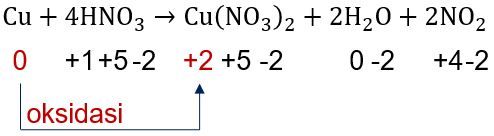Reaksi oksidasi merupakan reaksi yang ditandai dengan adanya kenaikan bilangan oksidasi.
Bilangan oksidasi (biloks) adalah bilangan yang menyatakan jumlah elektron.
Untuk menentukan bilangan oksidasi pada suatu unsur dapat ditentukan dengan menggunakan aturan bilangan oksidasi. Aturan tersebut sebagai berikut.
- Atom dalam unsur bebas atau senyawa unsur memiliki biloks = 0. Contoh:
 .
.
- Atom O dalam senyawa memiliki biloks = -2. Kecuali pada senyawa biner
 biloks 0 = +2 dan pada senyawa peroksida biloks O = -1.
biloks 0 = +2 dan pada senyawa peroksida biloks O = -1.
- Biloks atom H pada senyawa yang berikatan dengan non-logam = +1 dan pada logam = -1.
- Biloks unsur di dalam suatu ion tunggal = muatannya. Contoh:
 .
.
Sehingga biloks masing-masing unsur pada reaksi tersebut adalah:
Biloks Cu, karena Cu unsur bebas maka Cu = 0.
Biloks pada  ,
,  jika terionisasi menghasilkan:
jika terionisasi menghasilkan:

Biloks H = muatan = +1
Biloks N pada  dapat dicari dengan perhitungan berikut.
dapat dicari dengan perhitungan berikut.
Biloks O =-2, maka:

Biloks pada  ,
,  bila terionisasi menghasilkan:
bila terionisasi menghasilkan:

Biloks Cu = muatan = +2
Biloks N pada  dapat dicari dengan perhitungan berikut.
dapat dicari dengan perhitungan berikut.
Biloks O = -2, maka:

Biloks pada  , biloks H = +1 dan biloks O = -2.
, biloks H = +1 dan biloks O = -2.
Biloks pada  , biloks O = -2, maka biloks N dapat dicari dengan perhitungan sebagai berikut.
, biloks O = -2, maka biloks N dapat dicari dengan perhitungan sebagai berikut.

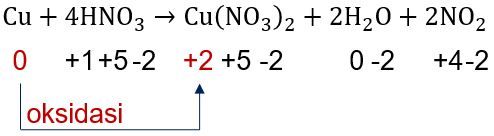
Pada reaksi tersebut, Cu mengalami kenaikan bilangan oksidasi dari 0 menjadi +2 sehingga hasil oksidasinya adalah  .
.
Jadi, jawaban yang benar adalah  .
.