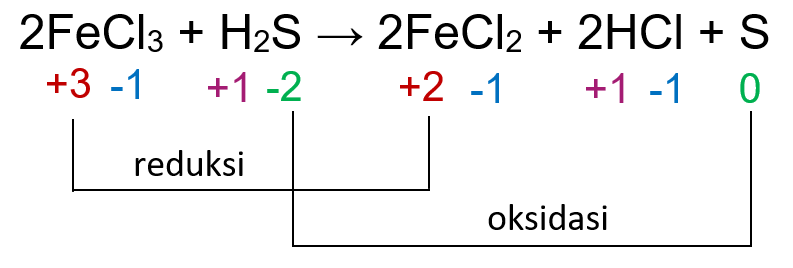Iklan
Pertanyaan
Diketahui reaksi redoks: 2 FeCI 3 + H 2 S → 2 FeCI 2 + 2 HCI + S Berapa perubahan biloks unsur pengoksidasi dan pereduksinya!
Diketahui reaksi redoks:
Berapa perubahan biloks unsur pengoksidasi dan pereduksinya!
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
1
5.0 (5 rating)
sn
saiyidatina nurfitriyah
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia