Iklan
Pertanyaan
Diketahui konfigurasi elektron unsur Z, yaitu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 3 . a. Elektron terakhir unsur Z memiliki: bilangan kuantum utama: n = ..., bilangan kuantum azimuth: l = ..., bilangan kuantum magnetik: m = ..., dan bilangan kuantum spin: s =... b. Unsur Z terletak pada golongan = .... dan periode = ....
Diketahui konfigurasi elektron unsur Z, yaitu .
a. Elektron terakhir unsur Z memiliki:
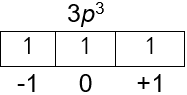
- bilangan kuantum utama: n = ...,
- bilangan kuantum azimuth: l = ...,
- bilangan kuantum magnetik: m = ..., dan
- bilangan kuantum spin: s =...
b. Unsur Z terletak pada golongan = .... dan periode = ....
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
4
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia