Iklan
Pertanyaan
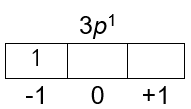
Diketahui elektron terakhir suatu atom unsur X memiliki bilangan kuantum n = 3, l = 1, m = -1, dan s = + 2 1 . Bagaimanacara yang mudah untukmenentukan periode dan golongan unsur Xtersebut? Gunakan cara yang diperoleh untukmenentukan golongan dan periode unsur Xtersebut.
Diketahui elektron terakhir suatu atom unsur X memiliki bilangan kuantum n = 3, l = 1, m = -1, dan s = .
- Bagaimana cara yang mudah untuk menentukan periode dan golongan unsur X tersebut?
- Gunakan cara yang diperoleh untuk menentukan golongan dan periode unsur X tersebut.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
41
3.0 (3 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia