Iklan
Pertanyaan
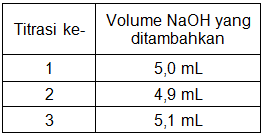
Data hasil titrasi 10 ml larutan asam H 2 SO 4 dengan larutan NaOH 0,1 M sebagai berikut. Hitung molaritas asam yang bereaksi! Tulis persamaan reaksi tersebut! Indikator apakah yang akan digunakan pada titrasi tersebut?
Data hasil titrasi 10 ml larutan asam dengan larutan 0,1 M sebagai berikut.
- Hitung molaritas asam yang bereaksi!
- Tulis persamaan reaksi tersebut!
- Indikator apakah yang akan digunakan pada titrasi tersebut?
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
1
4.6 (8 rating)
TI
Taufik Ihsan Harahap
Pembahasan lengkap banget
NA
Nazwa Alya Putri
Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia