Untuk reaksi diatas, H2 mengalami reaksi oksidasi (reduktor) dari 0 menjadi +1, sedangkan O2 mengalami reaksi reduksi (oksidator) dari 0 menjadi −2.
Berdasarkan konsep perubahan bilangan oksidasi, reaksi reduksi dan oksidasi didefinisikan sebagai:
- Reaksi reduksi: reaksi penurunan bilangan oksidasi, zat yang mengalami reaksi reduksi disebut oksidator.
- Reaksi oksidasi: reaksi kenaikan bilangan oksidasi, zat yang mengalami reaksi oksidasi disebut reduktor.
Terdapat beberapa ketentuan penentuan bilangan oksidasi unsur, diantaranya:
- Bilangan oksidasi unsur bebas (tidak bersenyawa) adalah nol (0).
- Jumlah aljabar bilangan oksidasi seluruh atom-atom dalam suatu senyawa netral adalah nol (0).
- Atom hidrogen (H) di dalam senyawa umumnya mempunyai bilangan oksidasi +1, kecuali dalam hidrida logam bilangan oksidasi H adalah −1.
- Atom oksigen (O) di dalam senyawa umumnya mempunyai bilangan oksidasi −2, kecuali pada senyawa peroksida (bilangan oksidasi O = −1), dan pada OF2 (bilangan oksidasi O = +2).
Maka, untuk reaksi berikut:
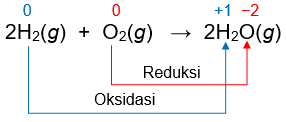
adalah benar reaksi redoks. Atom H mengalami kenaikan biloks (oksidasi) dari 0 menjadi +1, atom O mengalami penurunan biloks (reduksi) dari 0 menjadi −2.
- Reduktor: H2
- Oksidator: O2
- Hasil oksidasi: H2O
- Hasil reduksi: H2O
Oleh karena hasil oksidasi sama dengan hasil reduksi, reaksi di atas merupakan reaksi redoks spesial, yaitu reaksi konproporsionasi.
Jadi, zat H2 mengalami reaksi oksidasi (reduktor) dari 0 menjadi +1, sedangkan O2 mengalami reaksi reduksi (oksidator) dari 0 menjadi −2.
















