Iklan
Pertanyaan
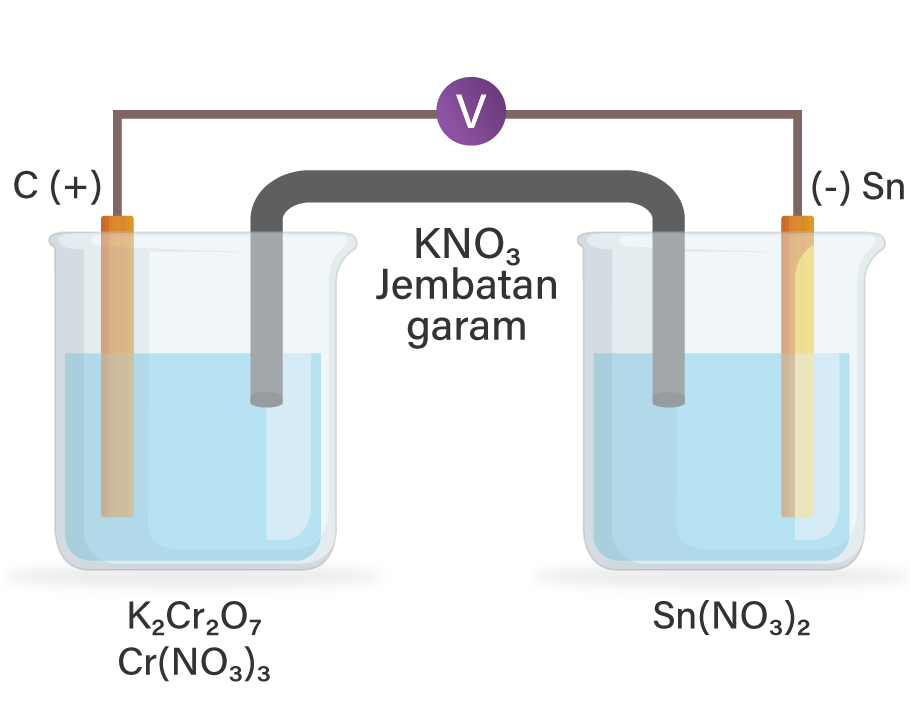
Dalam salah satu kompartemen sel volta, batang grafit dicelupkan ke dalam larutan asam K 2 Cr 2 O 7 dan Cr ( NO 3 ) 3 . Dalam kompartemen yang lain, batang timah (Sn) dimasukkan ke dalam larutan Sn ( NO 3 ) 2 . Kedua kompartemen dihubungkan dengan jembatan garam KNO 3 . Elektrode Sn bermuatan negatif dan elektrode grafit bermuatan positif. Gambarkan diagram sel, tunjukkan persamaan redoks yang terjadi, dan tuliskan notasi selnya.
Dalam salah satu kompartemen sel volta, batang grafit dicelupkan ke dalam larutan asam dan . Dalam kompartemen yang lain, batang timah (Sn) dimasukkan ke dalam larutan . Kedua kompartemen dihubungkan dengan jembatan garam . Elektrode Sn bermuatan negatif dan elektrode grafit bermuatan positif. Gambarkan diagram sel, tunjukkan persamaan redoks yang terjadi, dan tuliskan notasi selnya.
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
2
4.0 (6 rating)
Helsa Claudia
Pembahasan lengkap banget
Anon
Pembahasan terpotong
Zeronic Heronic
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia