Reaksi autoredoks (reaksi disproporsionasi) adalah reaksi redoks di mana satu unsur mengalami reaksi reduksi dan oksidasi sekaligus. Reduksi merupakan reaksi penurunan biloks (bilangan oksidasi), sedangkan oksidasi merupakan reaksi penurunan biloks.
Pada kelima reaksi di atas, yang termasuk reaksi autoredoks adalah reaksi pada pilihan jawaban A.
Aturan dalam menentukan biloks diantaranya:
- unsur bebas (Na, Mg, S, O2, I2, Br2) memiliki biloks = 0
- jumlah total biloks atom-atom dalam senyawa netral = 0
- biloks H = +1 kecuali pada senyawa hidrida (NaH, LiH, CaH2) biloksnya -1
- biloks O = −2, kecuali pada senyawa peroksida (H2O2 , Na2O2 , BaO2) biloksnya -1, pada superoksida (KO2 , RbO2) biloksnya -1/2, pada senyawa OF2 biloksnya +2
- biloks unsur logam dalam senyawanya bertanda (+) dan bergantung pada elektron valensinya. Contoh biloks Na = +1, Mg = +2, Al = +3
- biloks atom Cl = -1, kecuali jika bergabung dengan unsur yang lebih elektronegatif seperti HClO2 biloksnya menjadi +2
- biloks Cl pada Cl2 = 0, karena termasuk unsur bebas
- biloks Cl pada NaCl
(b.o Na) + (b.o Cl) = 0(+1) + Cl = 0Cl = −1
- biloks Cl pada NaClO
(b.o Na) + (b.o Cl) + (b.o O) = 0(+1) + Cl + (−2) = 0Cl + (−1) = 0Cl = +1
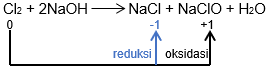
 mengalami reaksi oksidasi pada molekul
mengalami reaksi oksidasi pada molekul  , biloksnya mengalami peningkatan dari 0 menjadi +1 dan mengalami reduksi pada molekul
, biloksnya mengalami peningkatan dari 0 menjadi +1 dan mengalami reduksi pada molekul  , biloksnya mengalami penurunan dari 0 menjadi -1. Oleh karena itu Cl2 mengalami autoredoks.
, biloksnya mengalami penurunan dari 0 menjadi -1. Oleh karena itu Cl2 mengalami autoredoks.
Jadi, jawaban yang benar adalah A.
















