Iklan
Pertanyaan
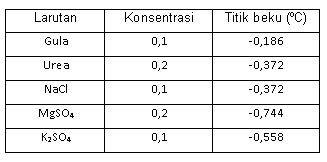
Berikut adalah data titik beku Tf berbagai larutan elektrolit dan non elektrolit. Berdasarkan data di atas, dapat disimpulkan bahwa ....
Berikut adalah data titik beku Tf berbagai larutan elektrolit dan non elektrolit.
Berdasarkan data di atas, dapat disimpulkan bahwa ....
titik beku larutan elektrolit lebih tinggi daripada larutan non elektrolit
pada konsentrasi sama, titik beku larutan elektrolit lebih rendah daripada larutan non elektrolit
makin besar konsentrasi zat, makin tinggi titik beku larutan
titik beku larutan dipengaruhi oleh jenis zat terlarut dan jenis pelarutnya
larutan elektrolit dengan konsentrasi yang sama mempunyai titik beku yang sama
Iklan
S. Lubis
Master Teacher
4
4.7 (29 rating)
Natanaja
Mudah dimengerti
Salsabil Cahya
Makasih ❤️
Siti Maesaroh
Makasih ❤️
Hadi Muhammad Khairil
Pembahasan lengkap banget
aneira hasya
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia