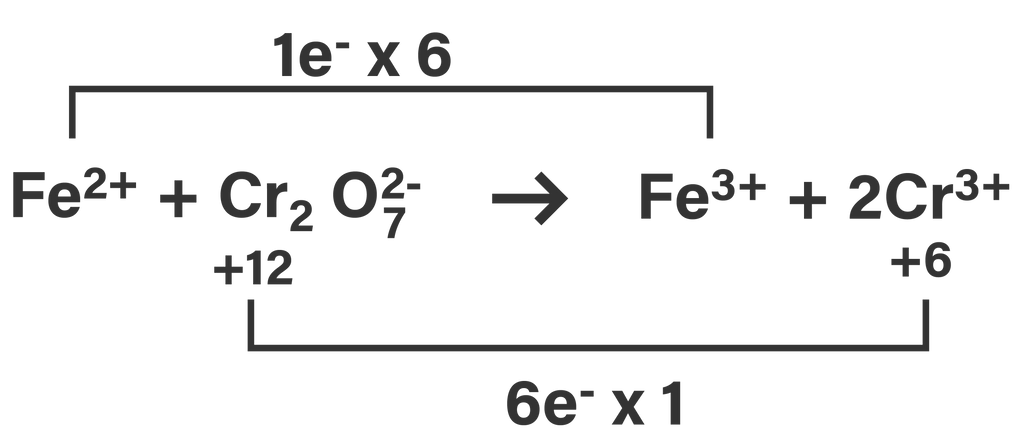Jawaban yang tepat adalah opsi E.
Cara penyetaraan persamaan reaksi redoks dapat dilakukan dengan dua cara, yaitu cara setengah reaksi dan cara perubahan bilangan oksidasi. Cara penyetaraan persamaan reaksi redoks dengan cara setengah reaksi yaitu dengan melihat elektron yang diterima atau dilepaskan, kemudian menyamakan jumlah elektronnya. Cara ini diutamakan untuk reaksi dengan suasana reaksi telah diketahui. Cara penyetaraan persamaan reaksi dengan cara perubahan bilangan oksidasi yaitu dengan cara melihat perubahan bilangan oksidasinya, lalu menyamakan perubahan bilangan oksidasi tersebut.
Cara penyetaraan persamaan reaksi di atas adalah dengan menentukan perubahan bilangan oksidasi atom dalam reaksi, kemudian menyamakan perubahan bilangan oksidasinya.
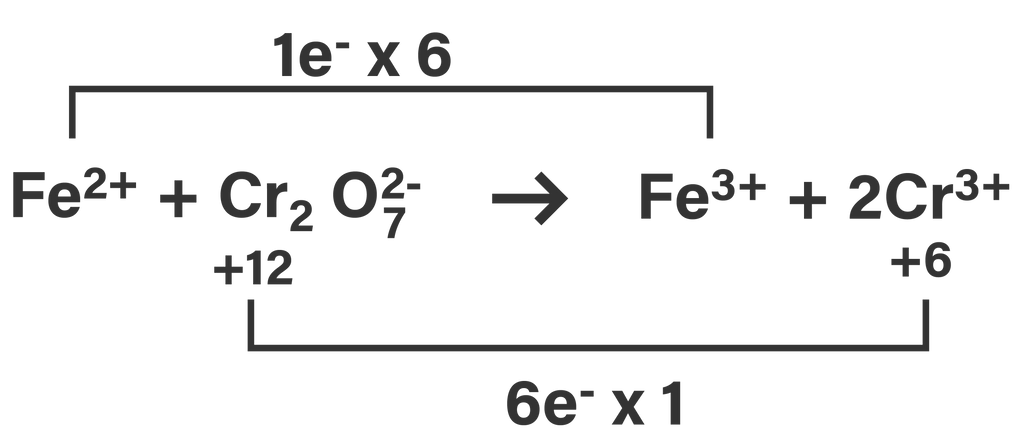
Pada persamaan reaksi di atas, atom Fe mengalami kenaikan biloks sebanyak 1, sedangkan atom Cr mengalami penurunan biloks sebanyak 6. Untuk menyamakan perubahan biloks keduanya, maka pada reaksi oksidasi reaksinya dikalikan 6, sedangkan pada reaksi reduksi reaksinya dikalikan 1 agar jumlah perubahan biloksnya sama dengan 6. Setelah dikalikan angka-angka pengali pada reaksi reduksi dan oksidasinya, maka persamaan reaksinya menjadi sebagai berikut.
6Fe2++Cr2O72−→6Fe3++2Cr3+
Selanjutnya, disetarakan jumlah atom O dengan menambahkan H2O pada ruas yang kekurangan atom O, serta menyetarakan jumlah atom H dengan menambahkan ion H+ pada ruas yang kekurangan atom H. Persamaan reaksi yang telah disetarakan adalah sebagai berikut.
6Fe2++Cr2O72−+14H+→6Fe3++2Cr3++7H2O
Dengan demikian, maka 1 mol ion Cr2O72− dapat mengoksidasi 6 mol Fe2+.