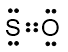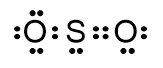Kepolaran menunjukkan adanya bagian atau daerah yang lebih positif dan lebih negatif daripada area lain (terbentuknya kutub) dalam suatu molekul. Perbedaan keelektronegatifan yang besar menyebabkan terbentuknya kutub positif dan negatif pada sisi yang berbeda. Selain itu, adanya pasangan elektron bebas dapat mengakibatkan bentuk molekul menjadi tidak simetris dan memiliki momen dipol tidak sama dengan 0, sehingga molekul bersifat polar. Untuk itu, kita perlu ketahui struktur Lewis molekul dan ion tersebut.
Konfigurasi elektron
16S8O==[Ne] 3s2 3p4 e−valensi: 6[He] 2s2 2p4 e−valensi: 6
Struktur Lewis molekul SO
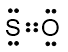
Karena ada perbedaan keelektronegatifan antara atom S dan O (O lebih elektronegatif), maka molekul ini bersifat polar.
Struktur Lewis SO2
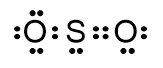
Adanya PEB pada atom S menyebabkan molekul ini tidak simetris dan jika digambarkan arah ikatan O - S sebagai vektor, resultan vektornya tidak sama dengan 0, artinya akan terbentuk kutub negatif pada daerah PEB dan di daerah berlawanan terbentuk kutub positif. Dengan demikian molekul ini bersifat polar.
Struktur Lewis SO3
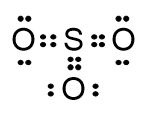
Walaupun ada perbedaan keelektronegatifan antara atom S dan O, molekul ini bersifat nonpolar. Hal ini disebabkan ikatan O - S sama kuat dengan arah berlawanan sehingga resultan vektornya sama dengan 0, disamping itu atom pusat tidak memiliki PEB yang mengubah sudut ikatan.
Struktur Lewis SO32−
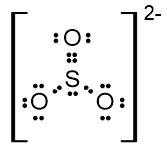
Molekul ini juga bersifat polar, ditandai dengan adanya PEB.
Struktur Lewis SO42−
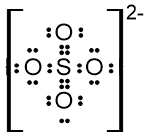
Jelas tampak bahwa molekul ion ini tidak memiliki PEB dan struktur tersebut bersifat nonpolar.
Dengan demikian, spesies yang bersifat nonpolar dan tidak memiliki PEB adalah SO3 dan SO42−.
Jadi, jawaban yang benar adalah E.