Atom harga n = 3 dan l = 4 tidak mungkin terjadi, namun jika 3s jumlah orbitalnya sebanyak 1, 3p jumlah orbitalnya sebanyak 3, dan 3d jumlah orbitalnya sebanyak 5.
Bilangan kuantum adalah bilangan yang digunakan sebagai penentu kedudukan elektron dalam atom. Terdapat empat jenis bilangan kuantum yaitu:
- Bilangan kuantum utama (n), yang menunjukkan kulit atom,
- Bilangan kuantum azimuth (l), yang menunjukkan subkulit atom,
- Bilangan kuantum magnetik (m), yang menunjukkan orientasi orbital, dan
- Bilangan kuantum spin (s), yang menunjukkan arah rotasi elektron.
Pada soal terdapat bilangan kuantum utama, n = 3 dan bilangan kuantum azimuth, l = 4. Namun pada kenyataannya, nilai bilangan kuantum azimuth untuk n = 3 tidak mencapai nilai 4. Sesuai aturannya, bilangan kuantum azimut yang mungkin adalah dari 0 samapai dengan n – 1. Besarnya nilai bilangan kuantum azimut dan lambang subkulitnya dijelaskan pada tabel berikut:
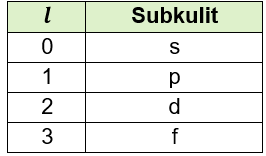
Subkulit s memiliki satu orbital, p memiliki 3 orbital, d memiliki 5 orbital, dan f memiliki 7 orbital. Pada kulit ketiga atau pada n = 3, subkulit yang mungkin adalah yang nilainya ≤2 yaitu s, p, dan d.
Jadi, tidak ada jawaban yang benar, namun jika atom memiliki harga n = 3 dan l = 0 atau 3s, jumlah orbitalnya sebanyak 1, untuk l = 1 atau 3p jumlah orbitalnya sebanyak 3, dan untuk l = 2 atau 3d jumlah orbitalnya sebanyak 5.
















